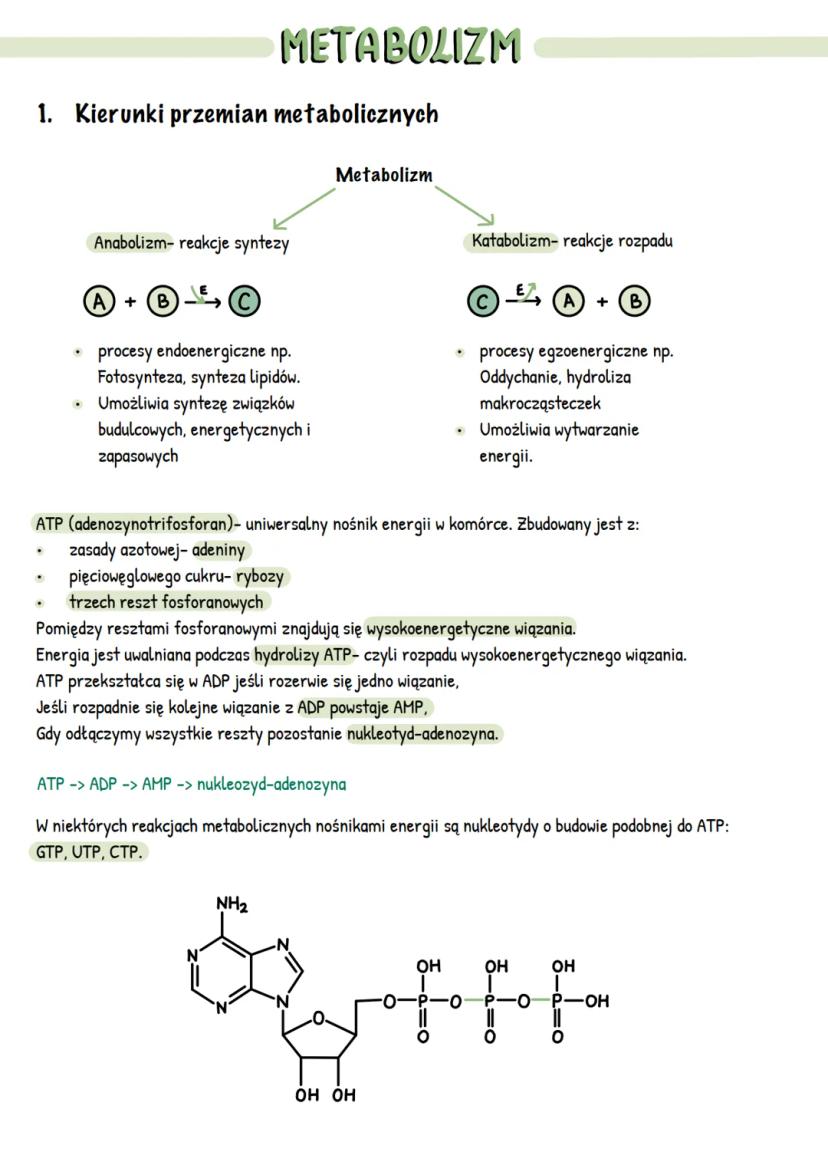
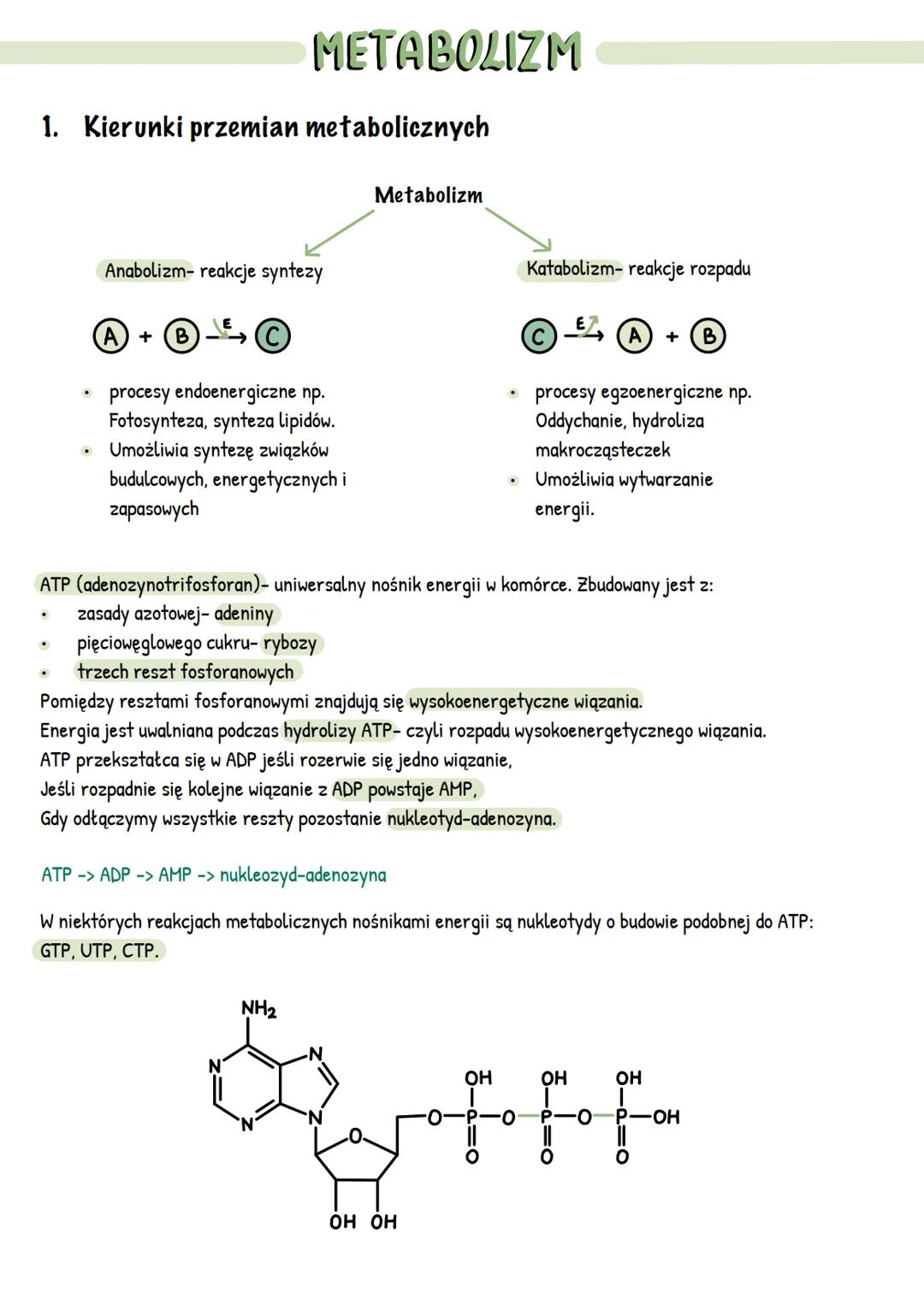
Właściwości i mechanizm działania enzymów
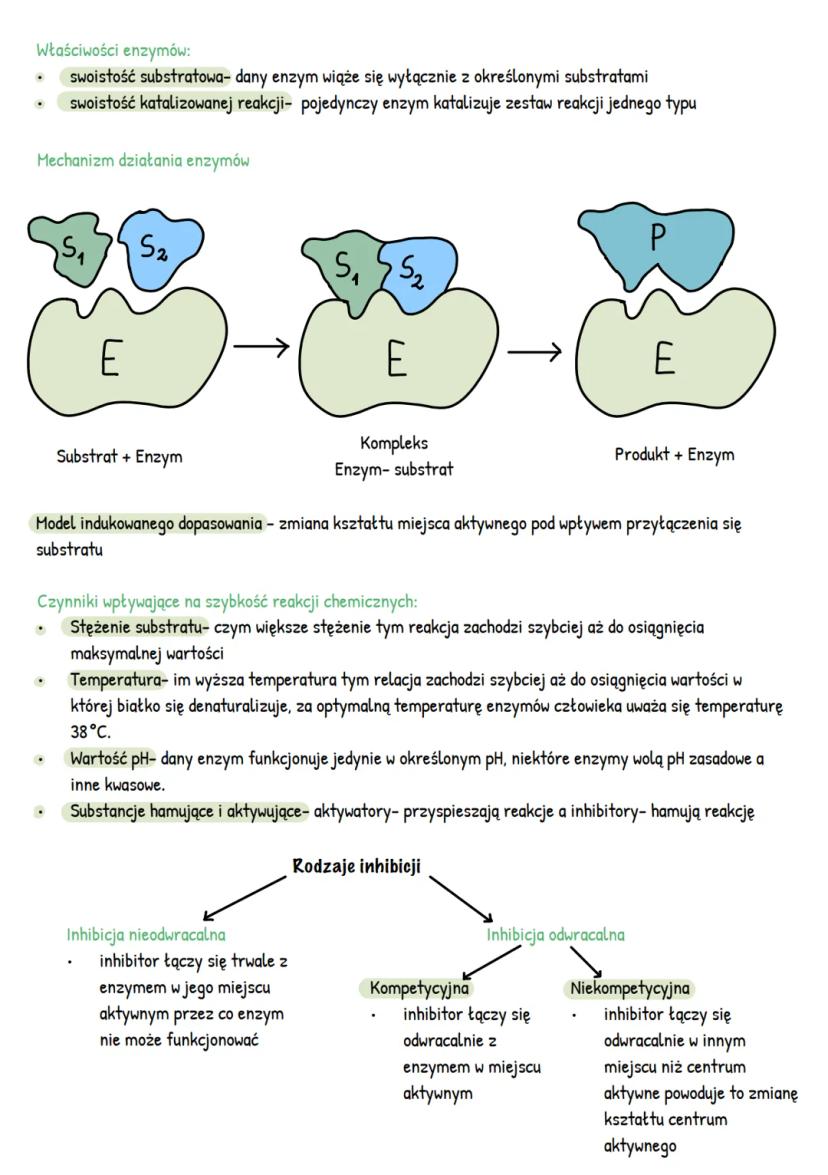
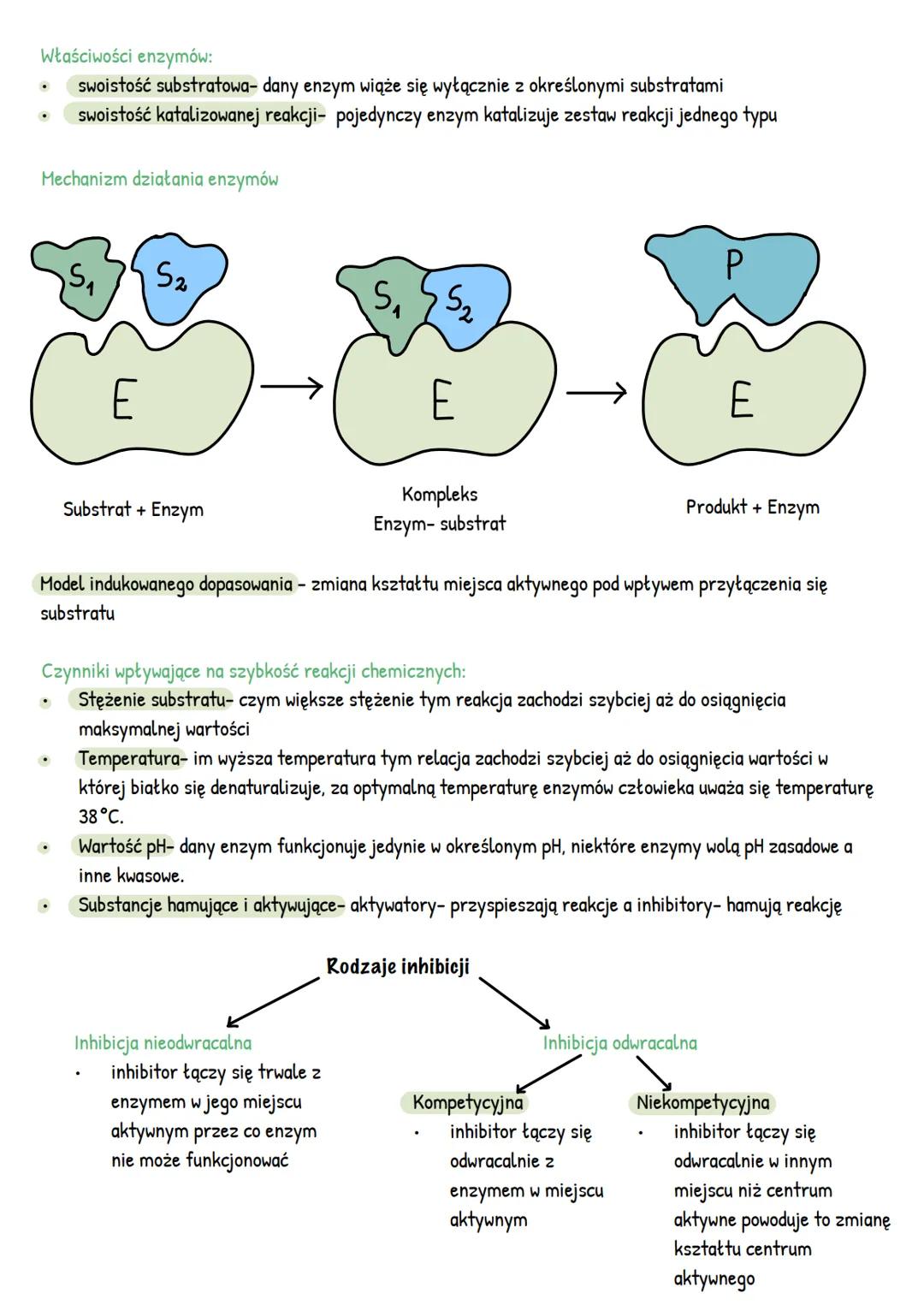
Enzymy charakteryzują się dwoma rodzajami swoistości: substratową (wiążą się tylko z określonymi substratami) oraz swoistością katalizowanej reakcji (dany enzym katalizuje tylko określony typ reakcji). Działanie enzymów można opisać modelem indukowanego dopasowania, gdzie kształt centrum aktywnego zmienia się pod wpływem przyłączenia substratu.
Na szybkość reakcji enzymatycznych wpływa kilka czynników. Wraz ze wzrostem stężenia substratu reakcja przyspiesza aż do osiągnięcia maksimum. Wyższa temperatura również przyspiesza reakcję, ale tylko do momentu denaturacji białka (dla enzymów ludzkich optymalna temperatura to około 38°C). Każdy enzym działa najefektywniej w określonym pH - niektóre preferują środowisko zasadowe, inne kwasowe.
Istnieją substancje, które mogą modyfikować działanie enzymów. Aktywatory przyspieszają reakcje, natomiast inhibitory je hamują. Inhibicja może być nieodwracalna (trwałe połączenie inhibitora z enzymem) lub odwracalna. W inhibicji kompetycyjnej inhibitor wiąże się z miejscem aktywnym, a w niekompetycyjnej - w innym miejscu, zmieniając kształt centrum aktywnego.
Zapamiętaj: Działanie enzymów przypomina klucz i zamek - substrat (klucz) pasuje tylko do konkretnego enzymu (zamka), co zapewnia precyzyjną kontrolę reakcji biochemicznych w organizmie.