Czynniki wpływające na działanie enzymów
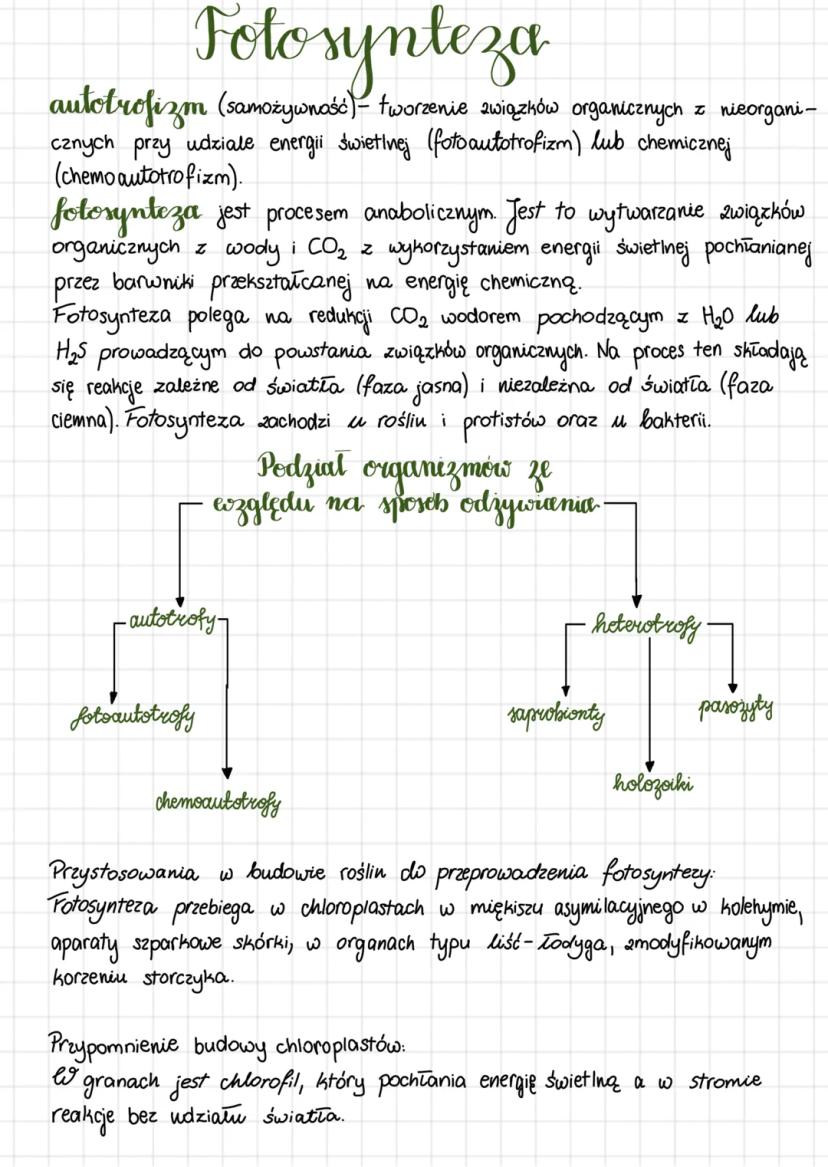
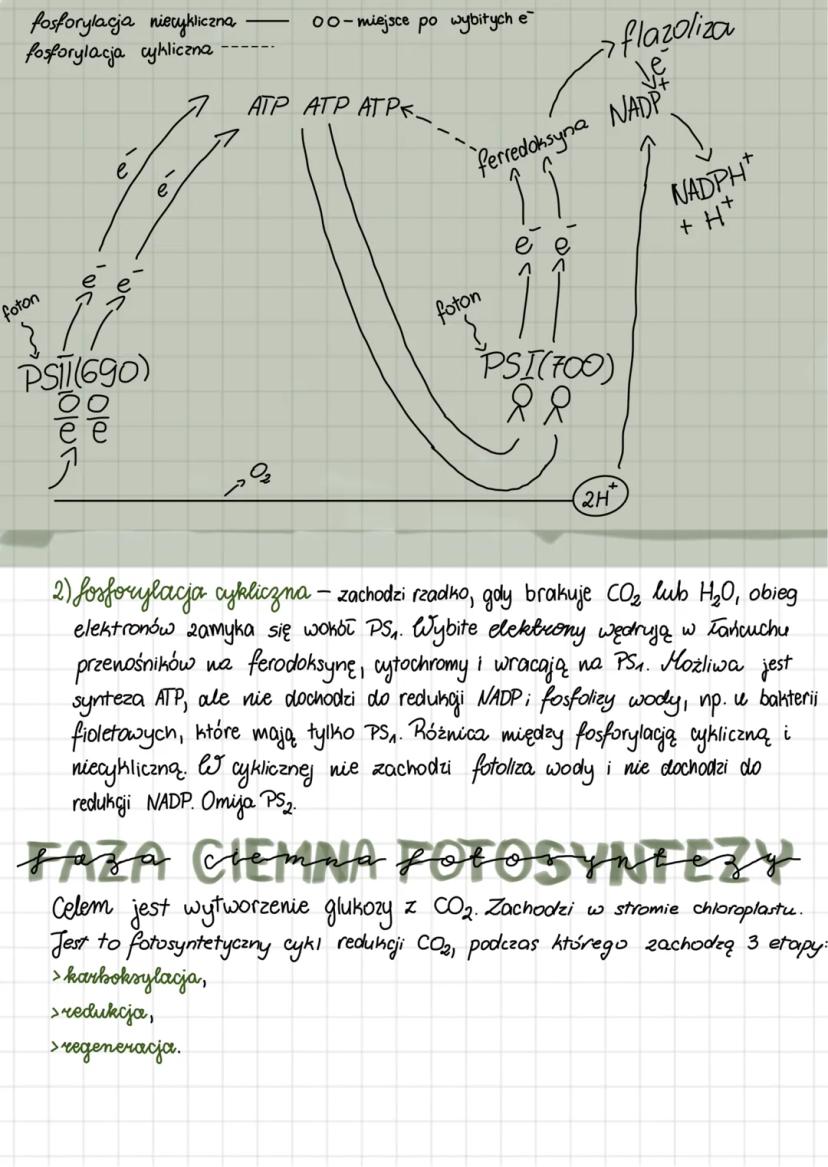
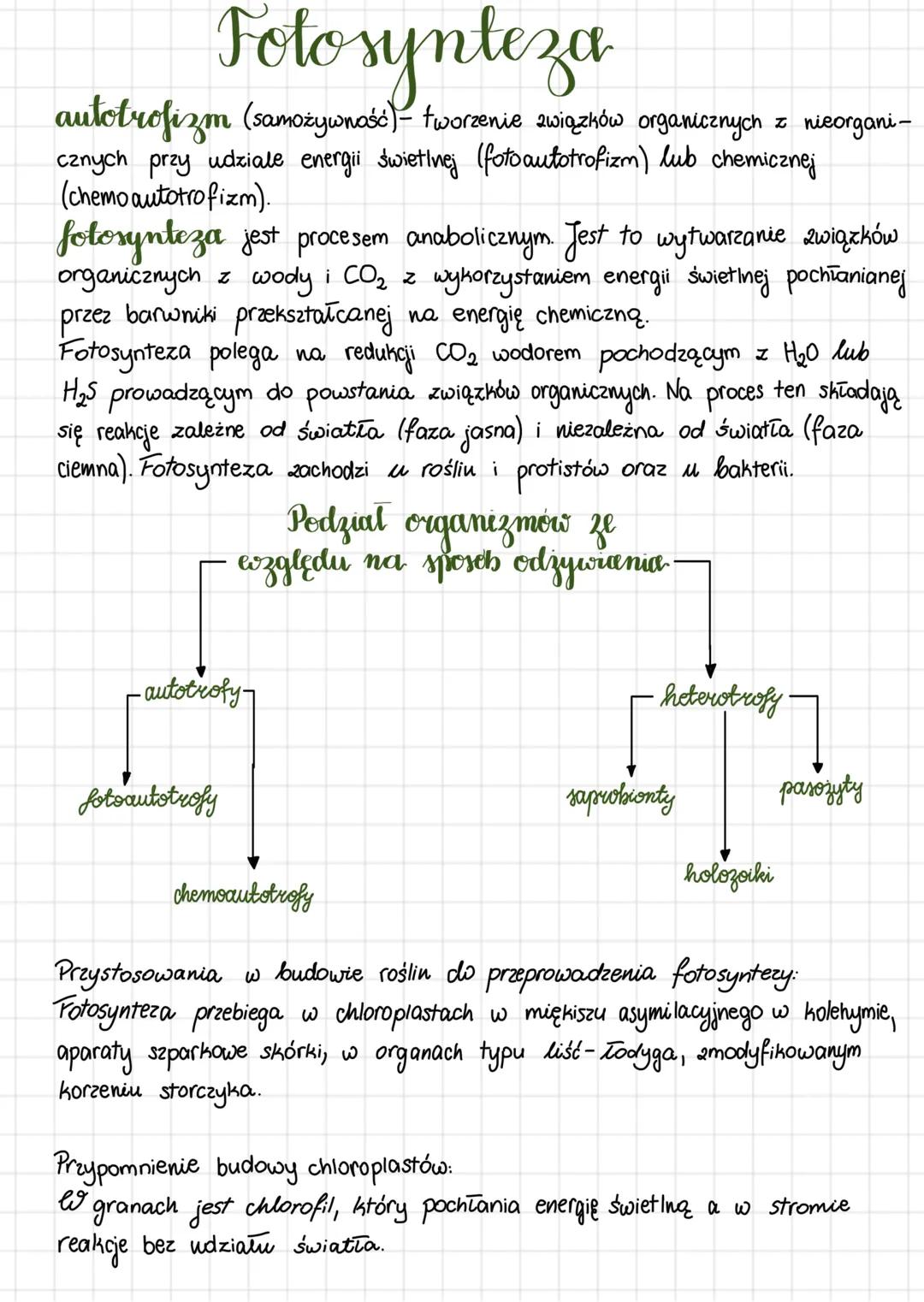
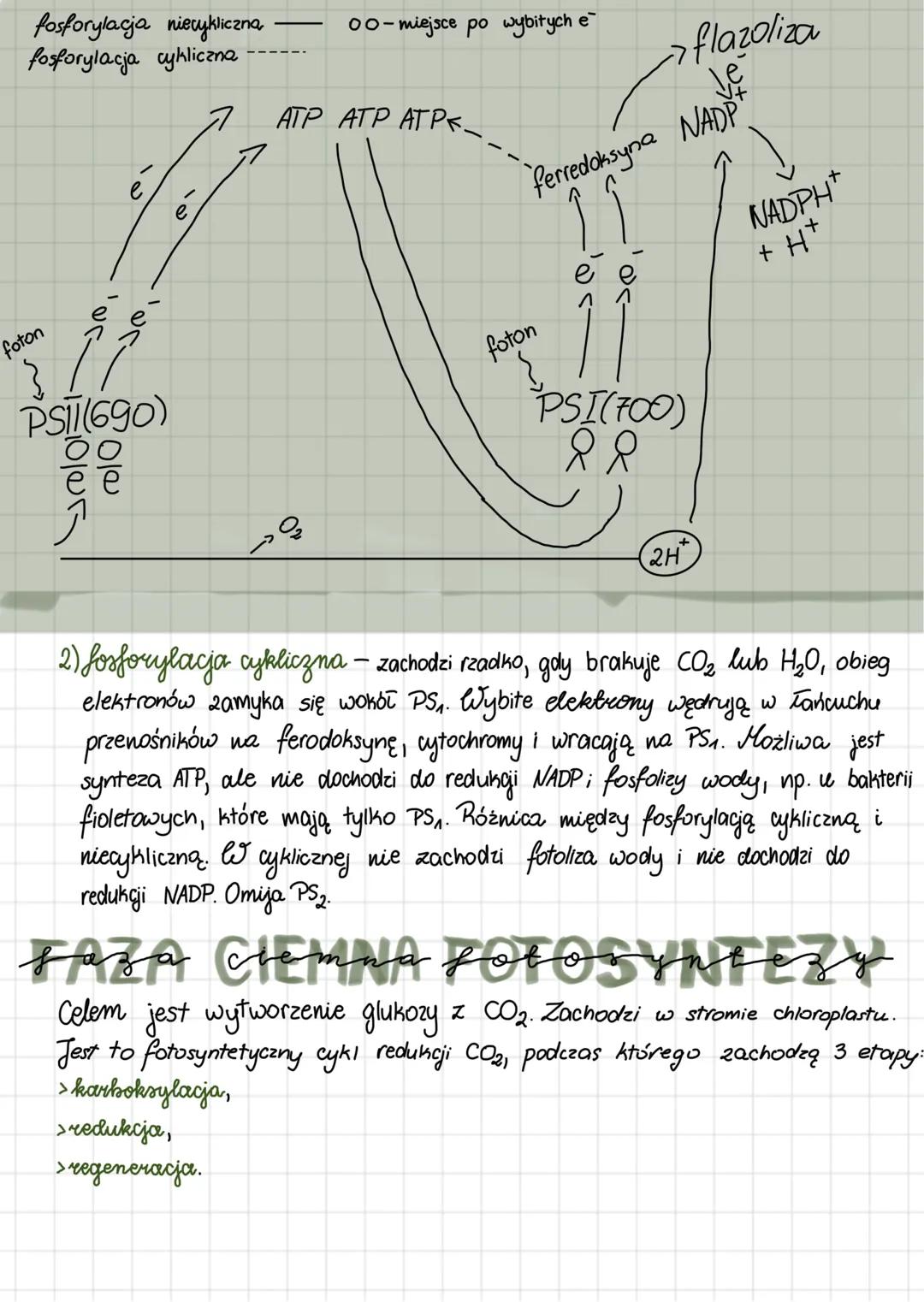
Enzymy mają wyjątkowe właściwości: przyspieszają reakcje, wykazują swoistość względem typu reakcji i substratu, a także nie zużywają się podczas katalizy. Szybkość reakcji enzymatycznych zależy od kilku czynników:
Stężenie enzymu i substratu - przy stałych warunkach, szybkość reakcji jest proporcjonalna do stężenia enzymu. Wzrost stężenia substratu zwiększa szybkość reakcji do pewnego poziomu, po czym utrzymuje się na stałym poziomie. Zależność tę opisuje krzywa Michaelisa.
Temperatura - każde podniesienie temperatury o 10°C może podwoić lub potroić szybkość reakcji, ale tylko w pewnym zakresie. Powyżej 40°C białka enzymatyczne ulegają denaturacji i tracą aktywność.
pH środowiska - większość enzymów działa najlepiej w środowisku obojętnym pH=7. Istnieją jednak wyjątki dostosowane do szczególnych warunków, np. pepsyna żołądkowa pH=2 czy trypsyna trzustkowa pH=8.
🧪 Stała Michaelisa (Km) to takie stężenie substratu, przy którym reakcja osiąga połowę maksymalnej szybkości. Mniejsza wartość Km oznacza większe powinowactwo enzymu do substratu!