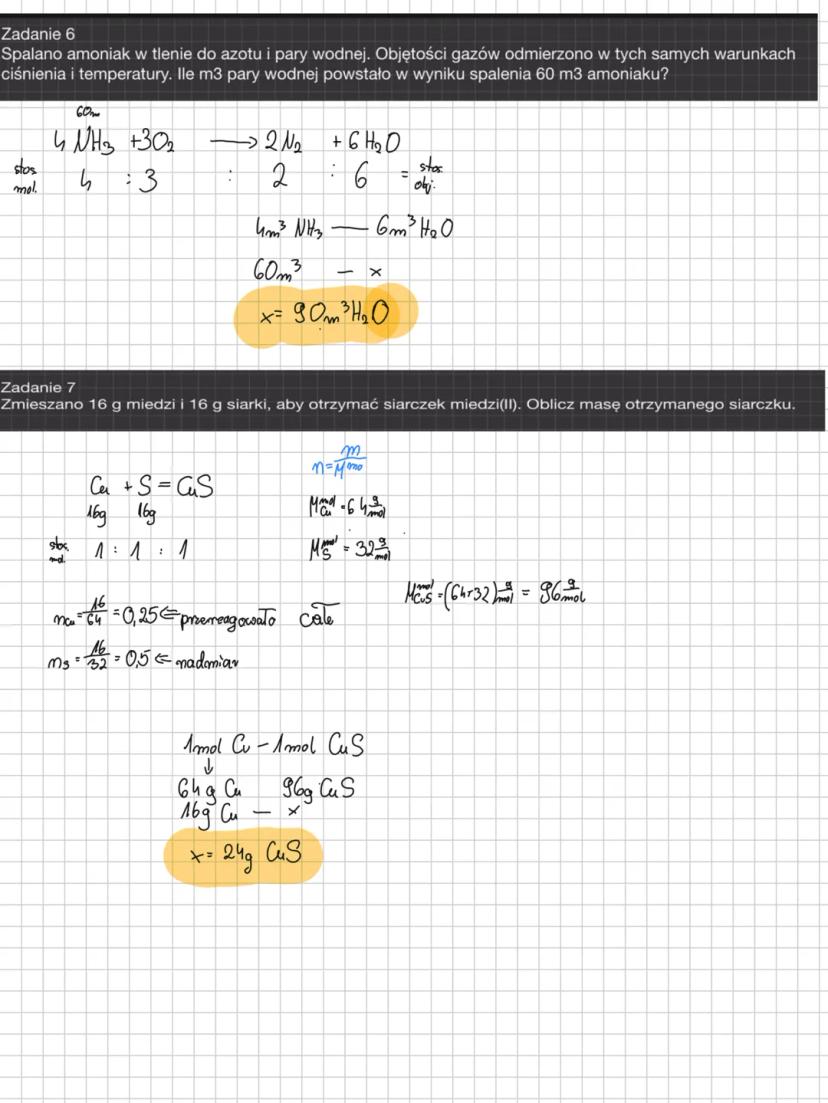
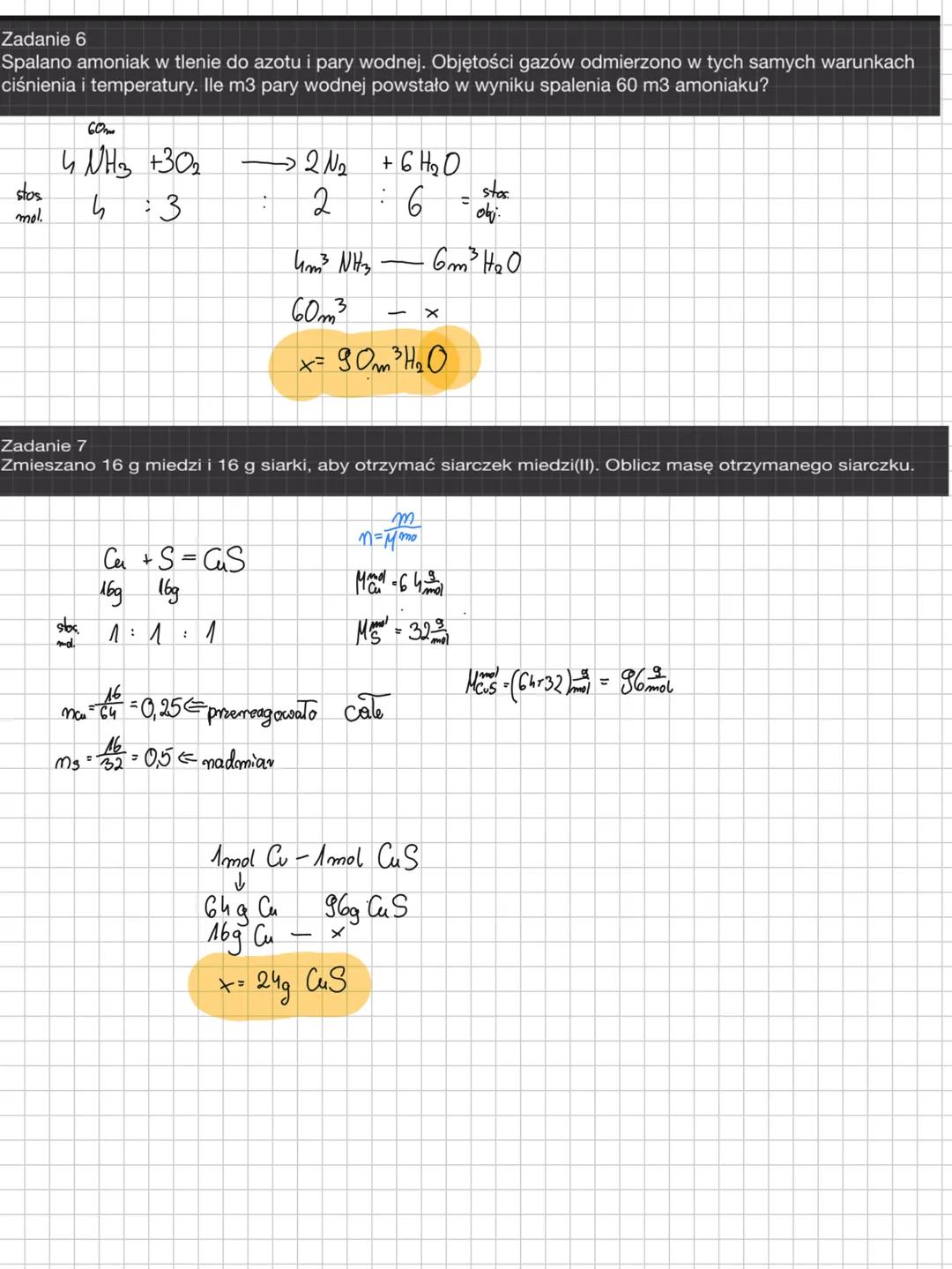
Podstawowe obliczenia stechiometryczne
Zacznijmy od prostych zadań, które pokażą ci, jak stechiometria działa w praktyce. Obliczanie liczby cząsteczek to świetny start - po prostu mnożysz liczbę moli przez liczbę Avogadra.
Gdy masz 0,35 mol azotu, to znaczy, że masz 0,35 × 6,02 × 10²³ = 2,107 × 10²³ cząsteczek N₂. Proste, prawda?
Obliczanie masy z liczby moli to kolejny podstawowy skill. Jeśli masz 0,45 mol miedzi, to masa wynosi: 0,45 mol × 64 g/mol = 28,8 g Cu. Wystarczy pomnożyć przez masę molową!
💡 Wskazówka: Zawsze sprawdzaj jednostki - to najłatwiejszy sposób na uniknięcie błędów w obliczeniach.
Dla objętości gazów w warunkach normalnych pamiętaj o magicznej liczbie 22,4 dm³/mol. Dla 2,5 mmol NH₃ objętość to po prostu 2,5 × 22,4 cm³ = 56 cm³.