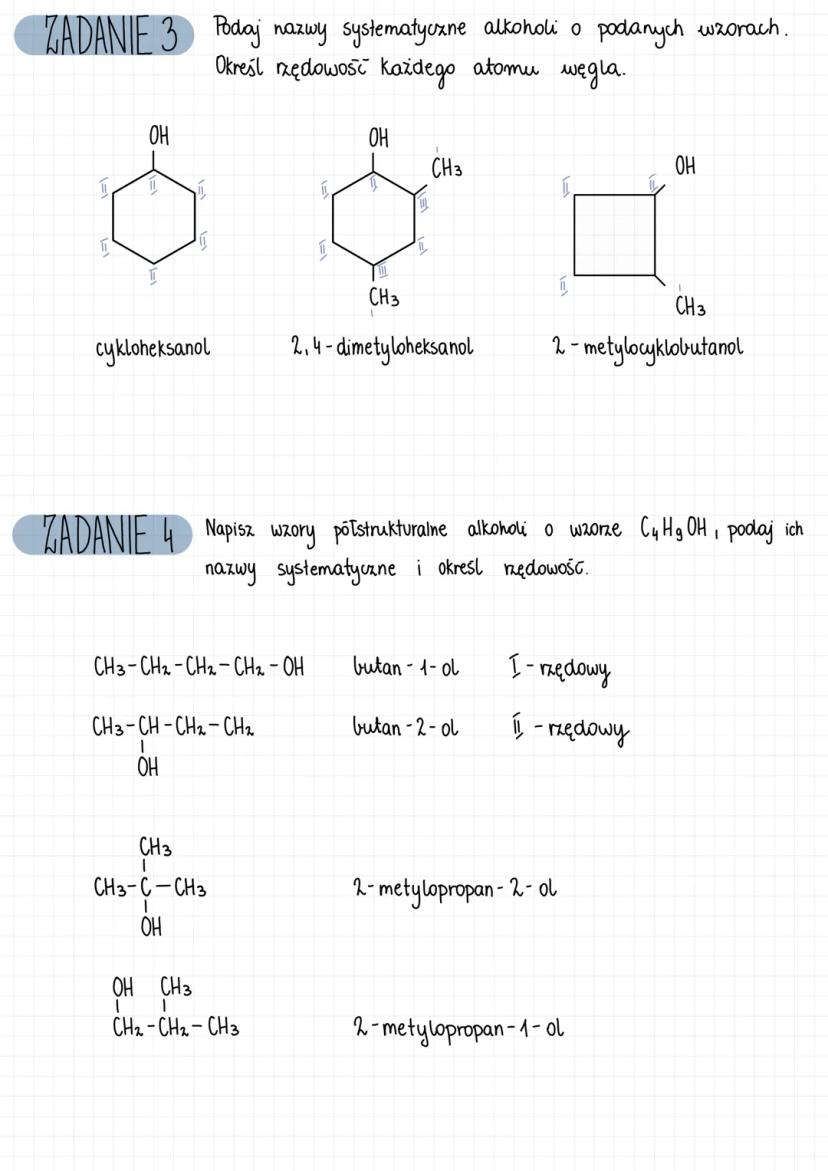
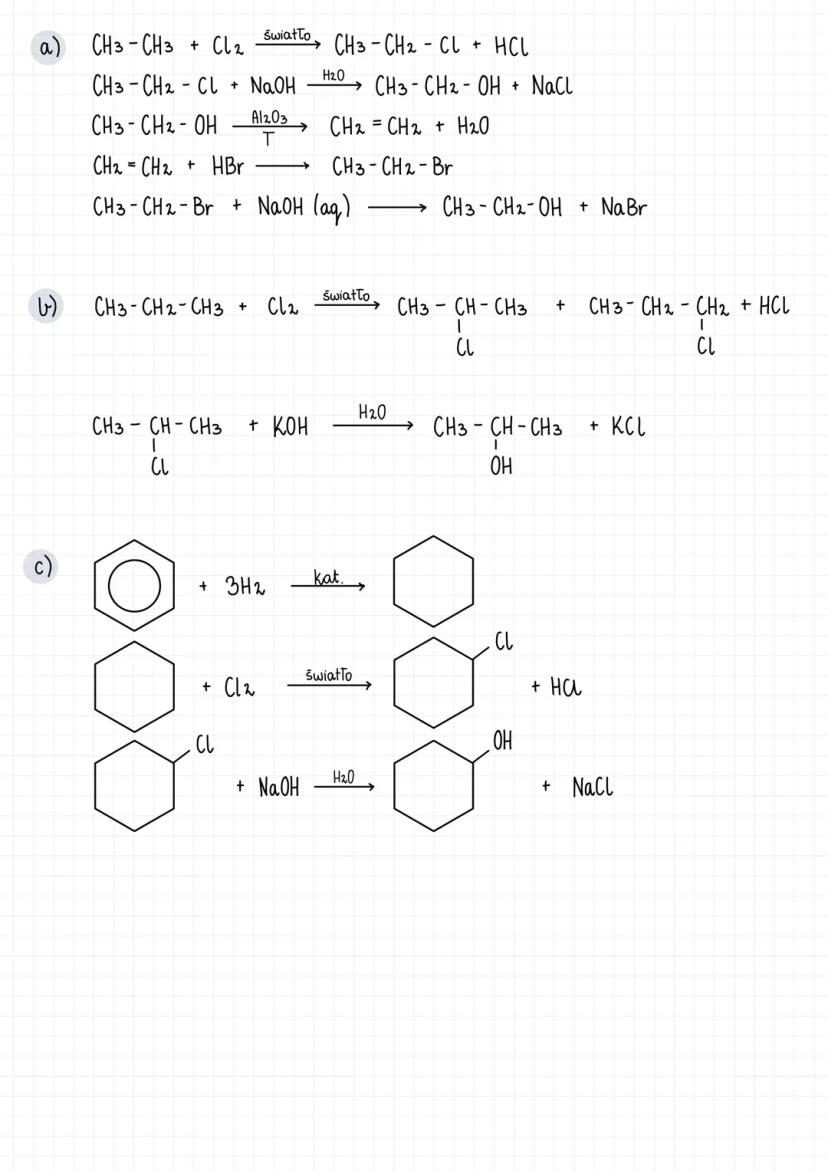
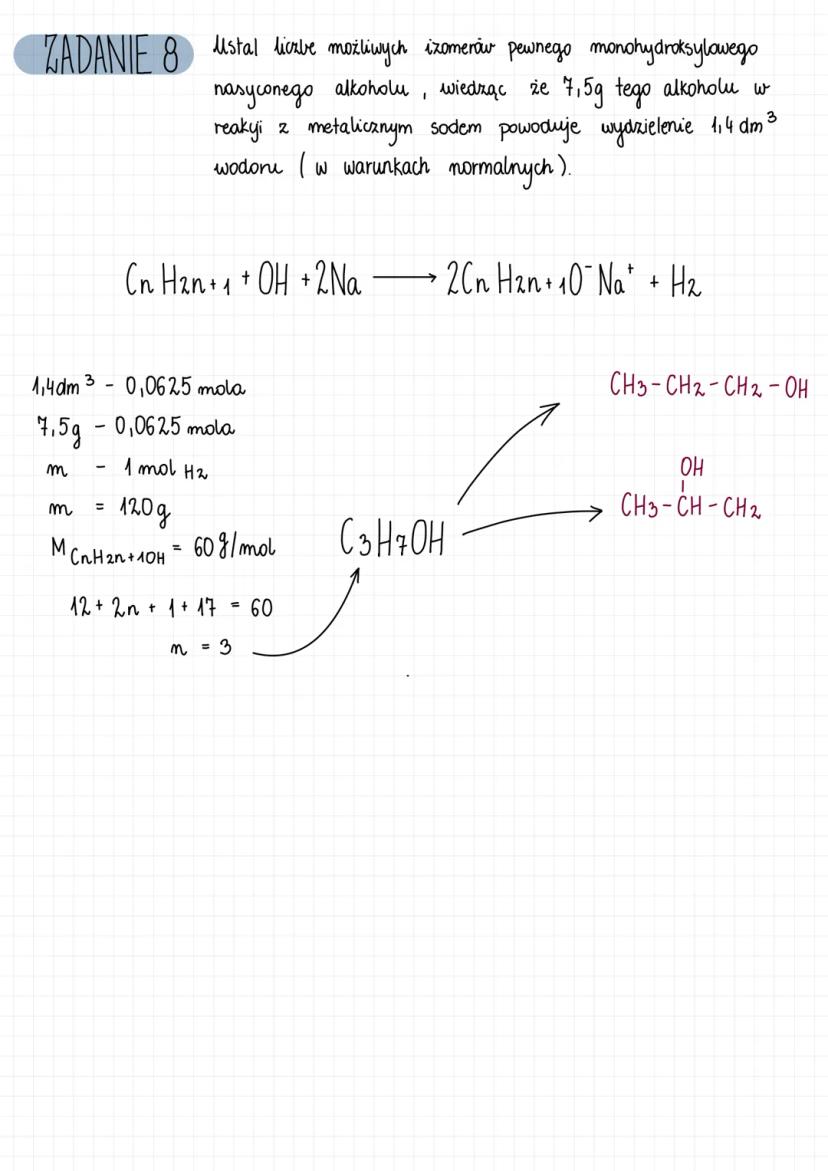
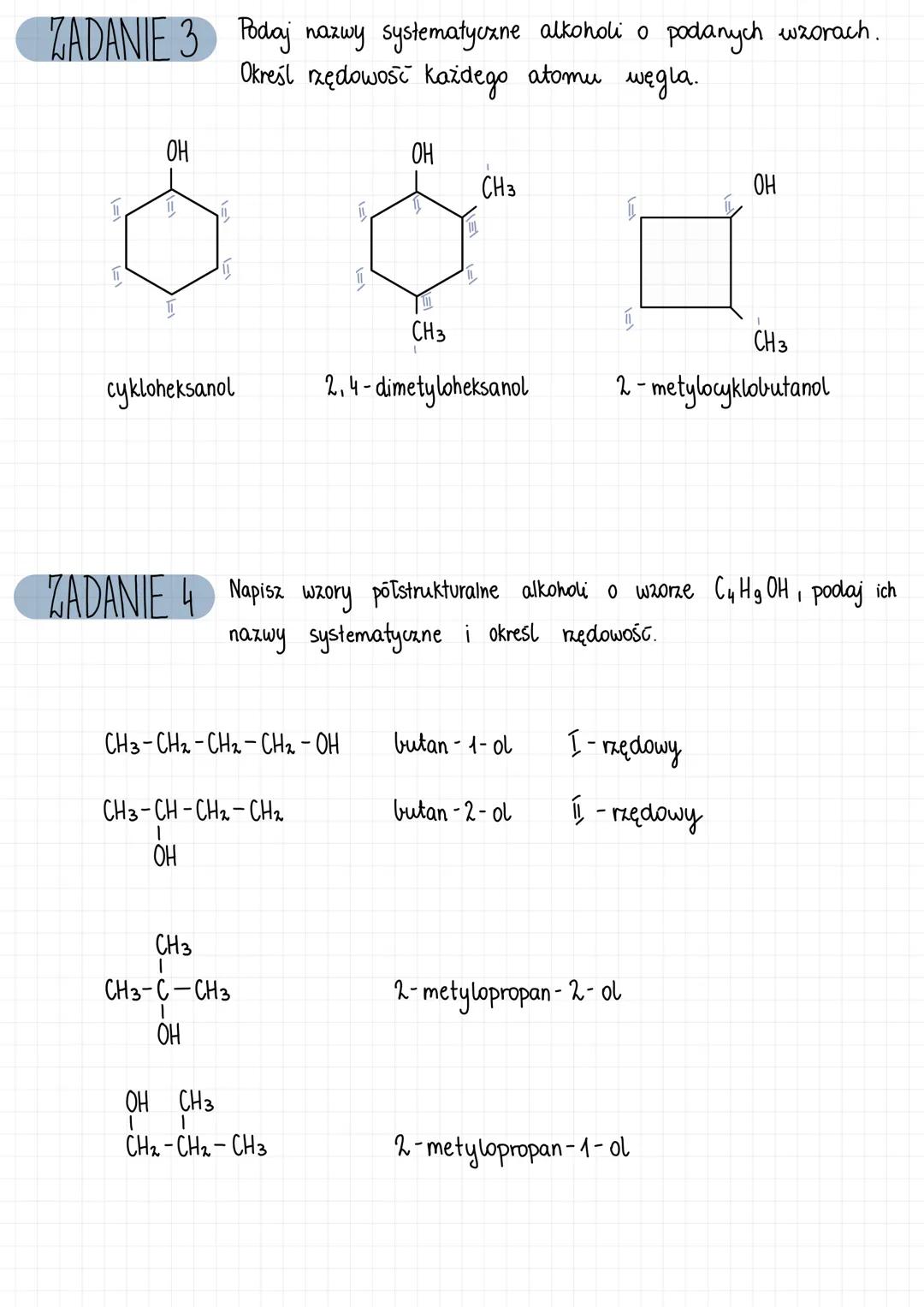
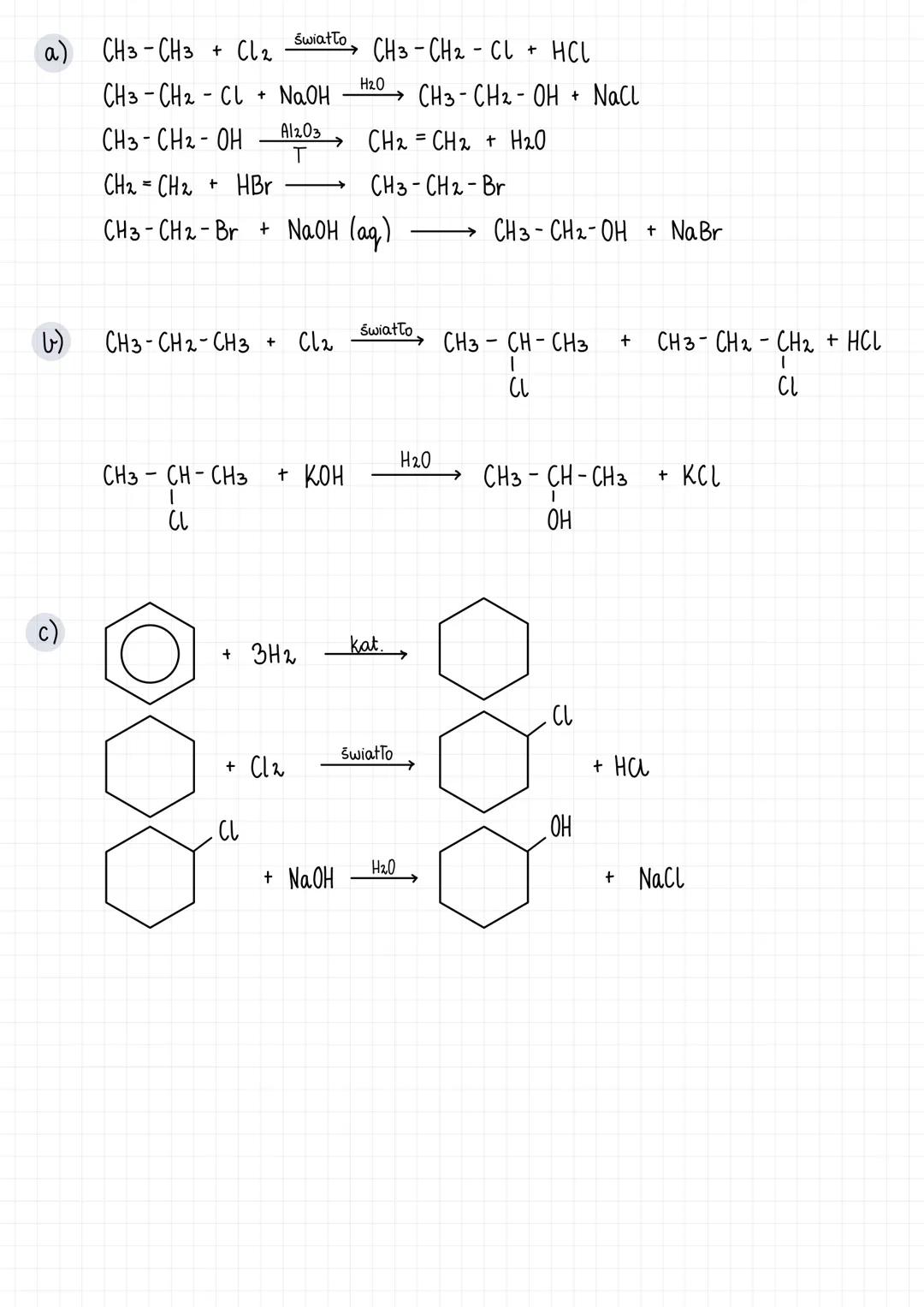
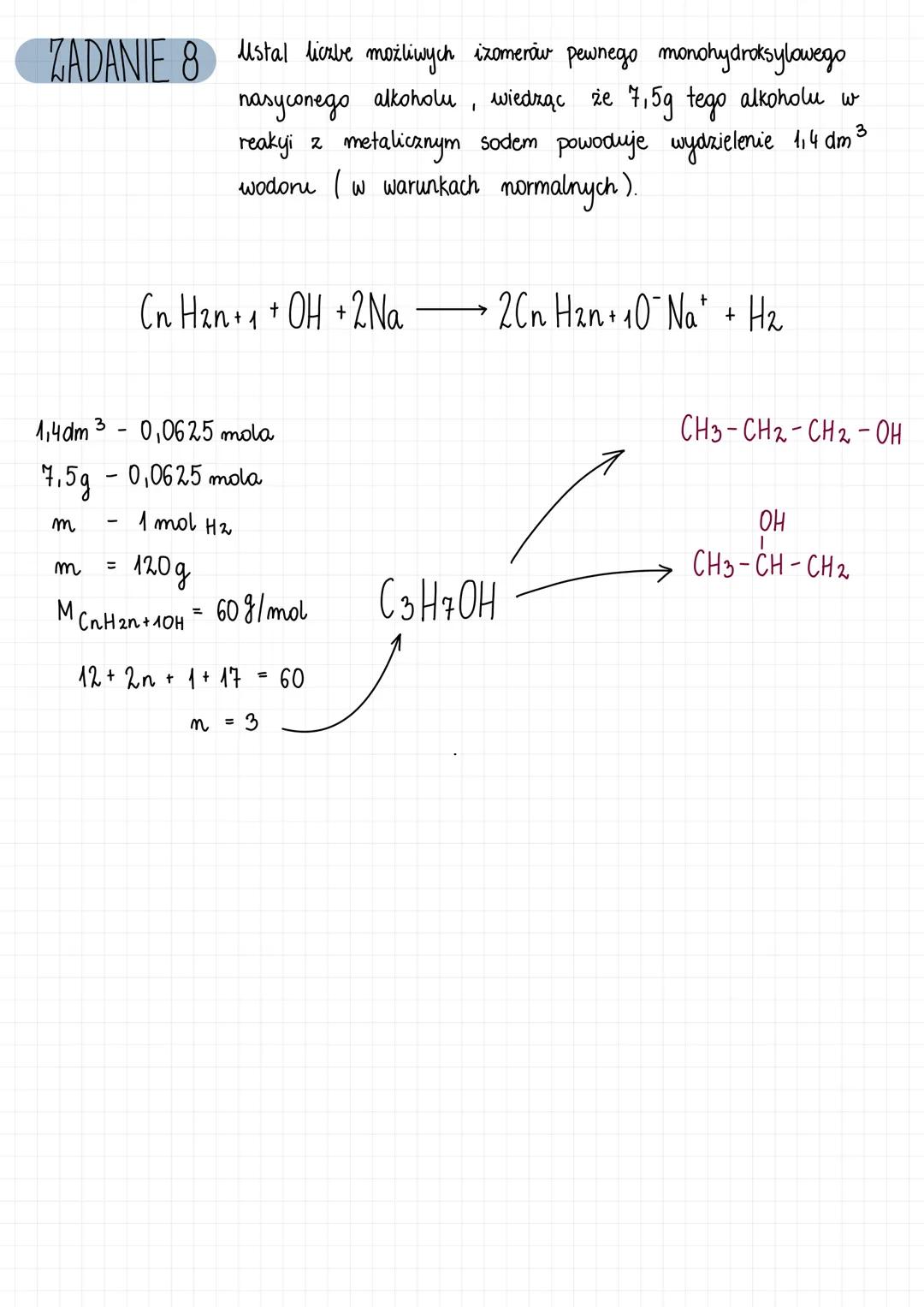
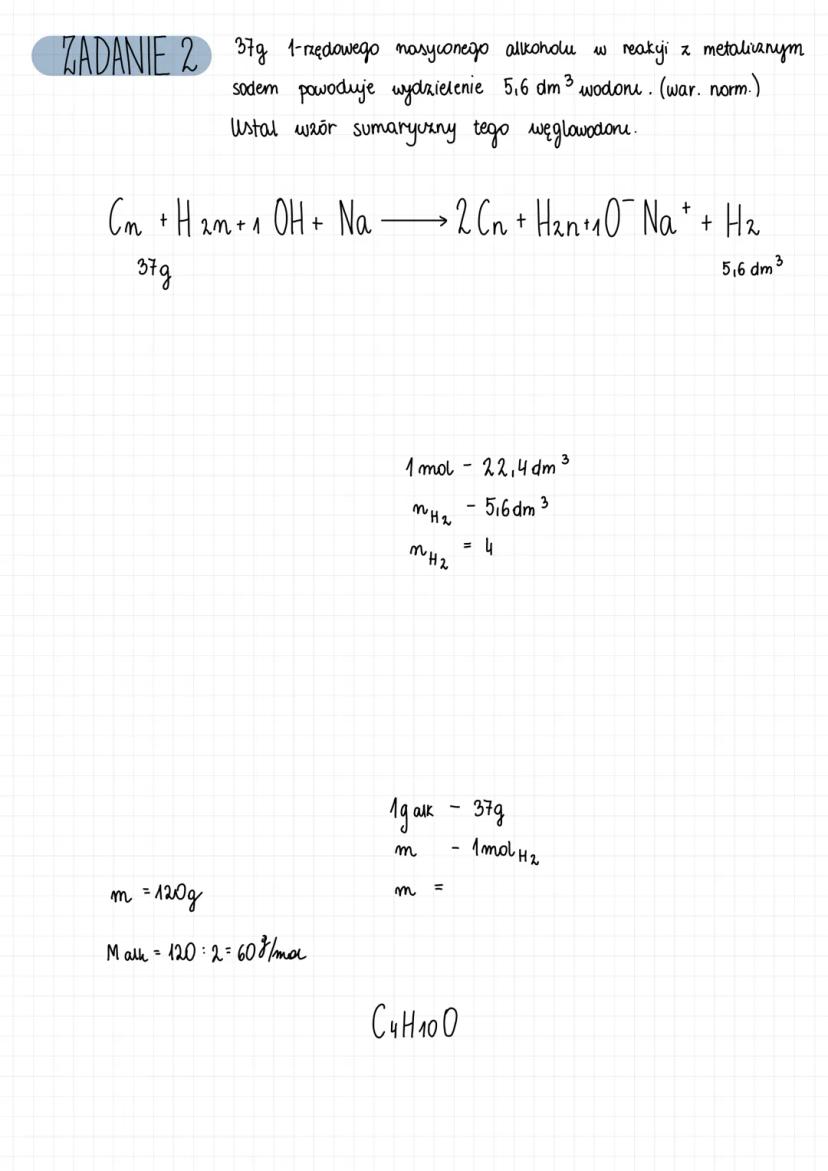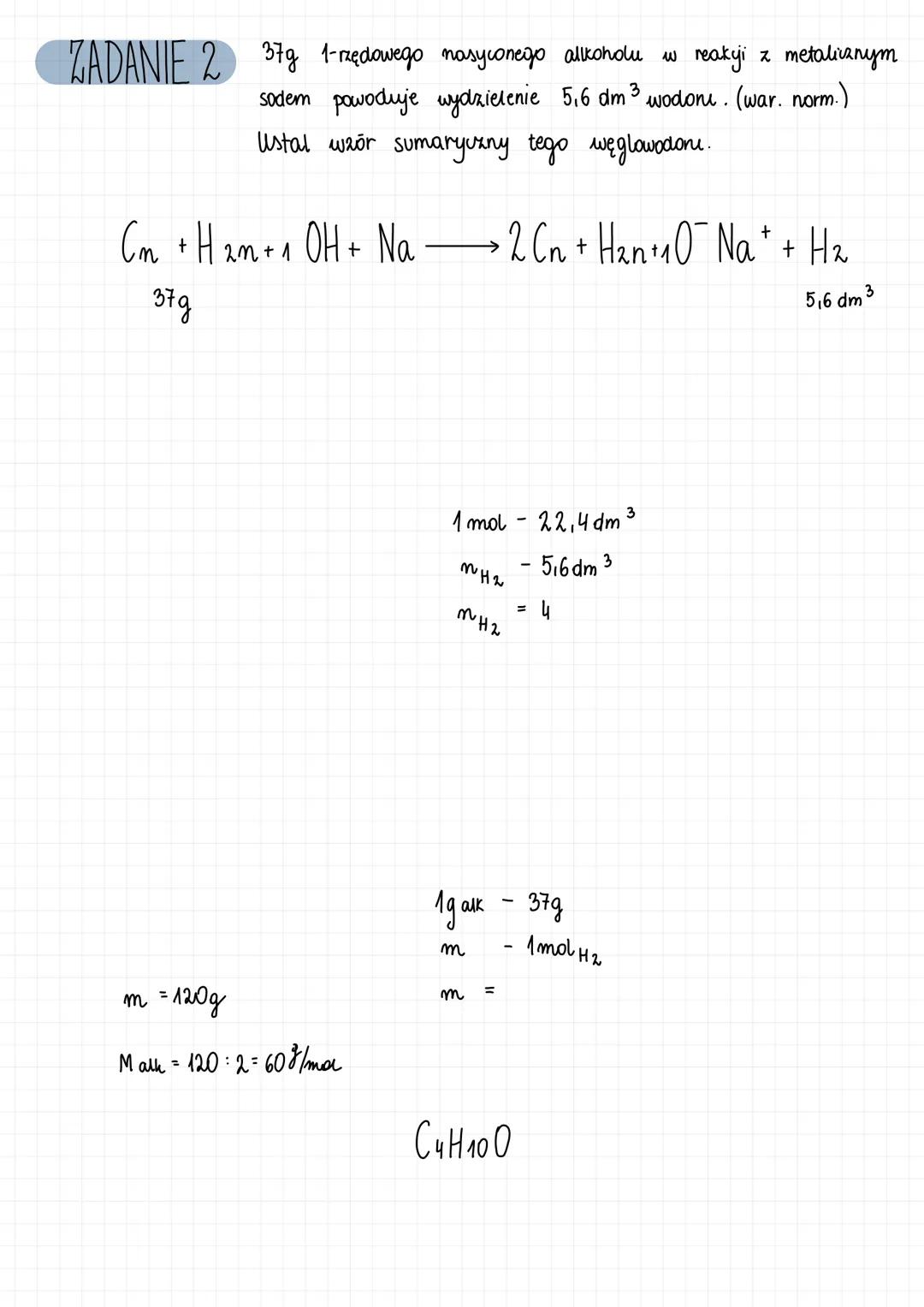Alkohol to związek organiczny o istotnym znaczeniu w chemii. Poznanie... Pokaż więcej
Zarejestruj się, aby zobaczyć notatkęTo nic nie kosztuje!
Dostęp do wszystkich materiałów
Popraw swoje oceny
Dołącz do milionów studentów
Rejestrując się akceptujesz Warunki korzystania z usługi i Politykę prywatności.