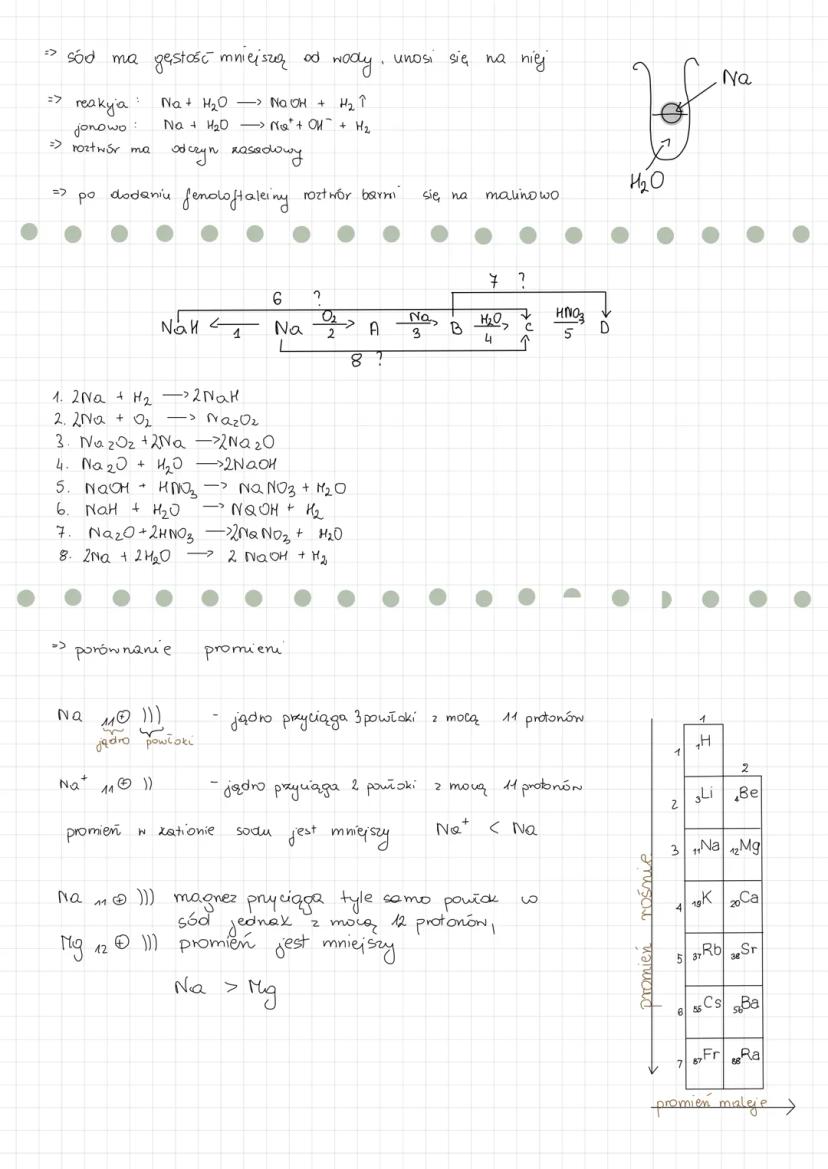
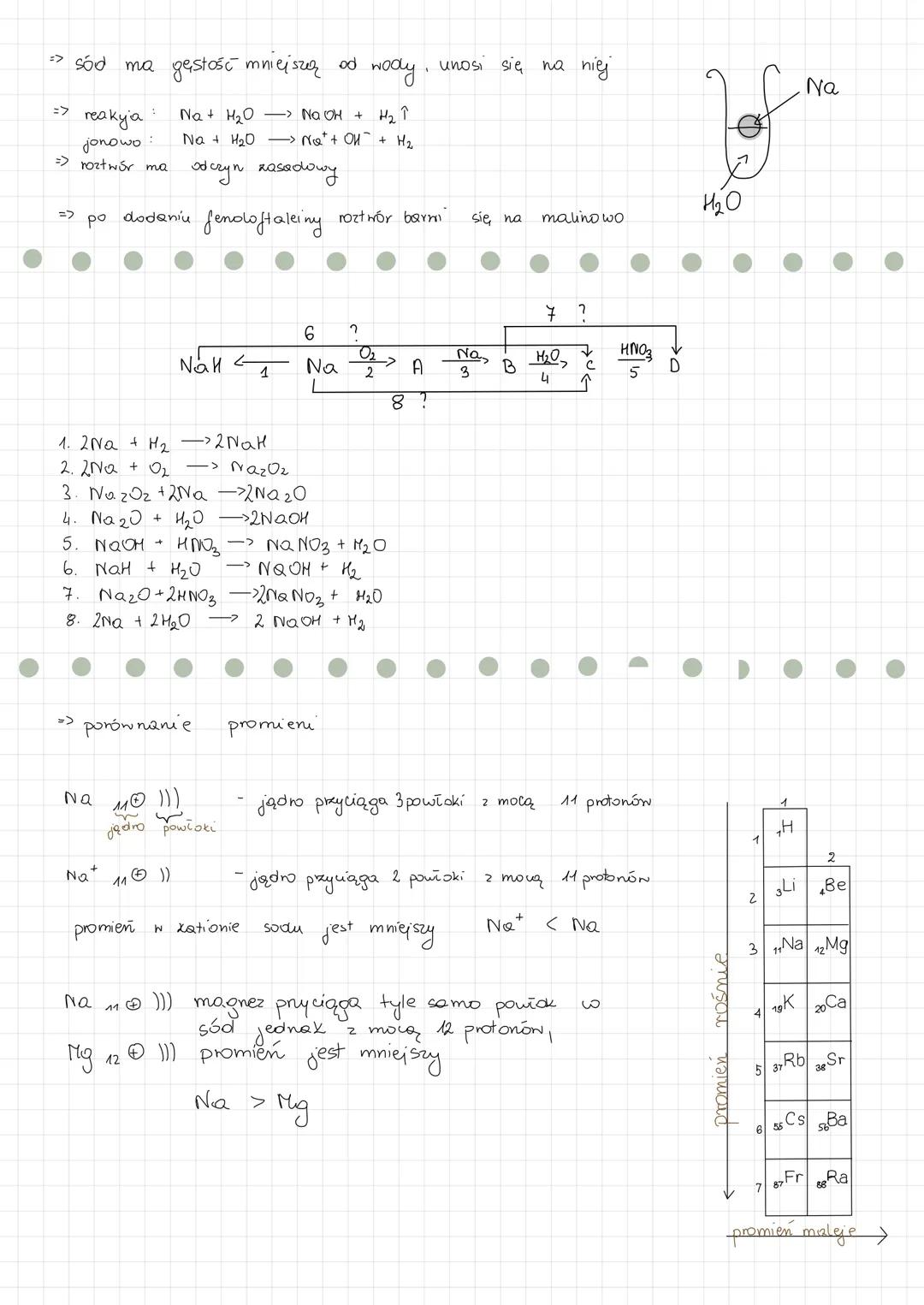
Magnez - metal o szerokim zastosowaniu
Magnez to srebrzystobiałe ciało stałe należące do 2 grupy, 3 okresu o konfiguracji elektronowej [Ne]3s². Jest metalem ziem alkalicznych, który pali się oślepiającym, białym płomieniem. Ten spektakularny efekt często wykorzystuje się w pirotechnice.
Magnez można otrzymać przez redukcję tlenku magnezu węglem w wysokiej temperaturze MgO+C→Mg+CO. Spala się w powietrzu, tworząc tlenek magnezu i azotek magnezu 2Mg+O2→2MgO,3Mg+N2→Mg3N2. Tlenek magnezu to biały proszek, który reaguje z wodą, tworząc wodorotlenek magnezu.
Jony magnezu (Mg²⁺) wraz z jonami wapnia (Ca²⁺) wchodzą w skład twardej wody, powodując osadzanie się kamienia. Można je usunąć, dodając jony węglanowe, które tworzą nierozpuszczalny węglan magnezu Mg2++CO32−→MgCO3↓.
Warto wiedzieć! Siarczan magnezu (MgSO₄), znany jako sól gorzka, ma szerokie zastosowanie medyczne - działa przeczyszczająco i obniża ciśnienie krwi. Powstaje w reakcji wodorotlenku magnezu z kwasem siarkowym Mg(OH)2+H2SO4→MgSO4+2H2O.