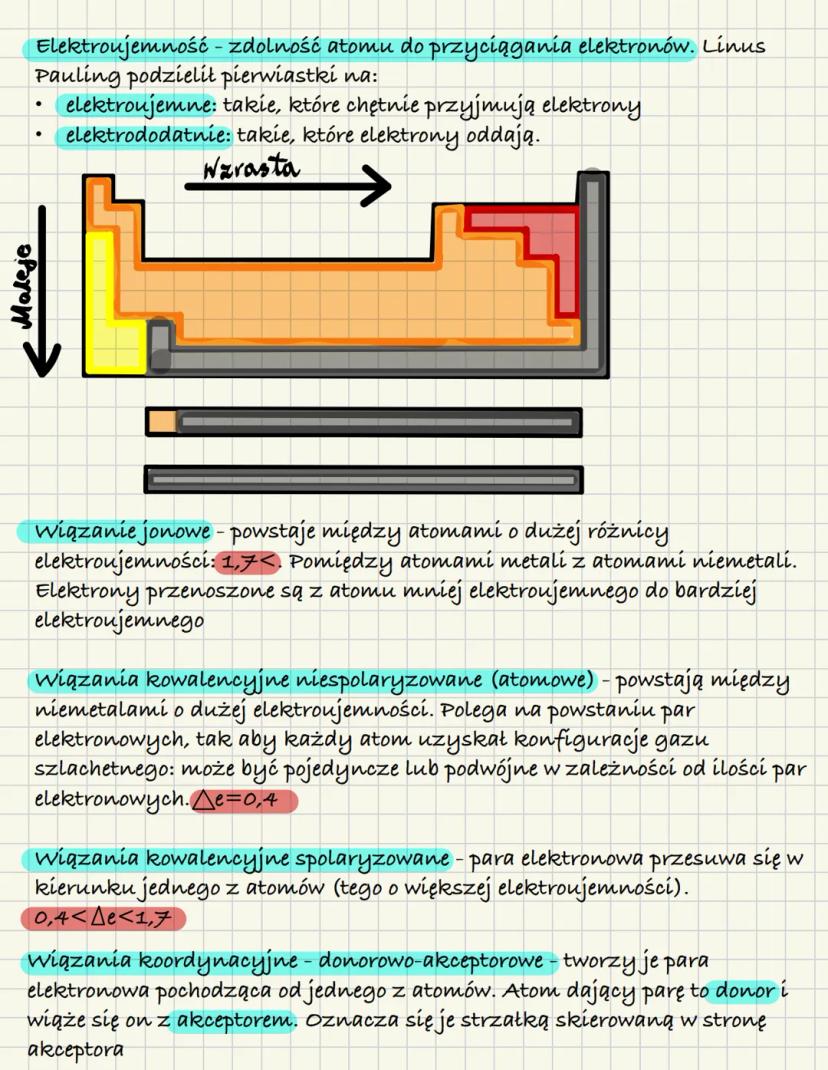
Liczby kwantowe i struktura atomu
Stan kwantowy elektronu w atomie opisują cztery liczby kwantowe - to jak adres elektronów w atomie! Główna liczba kwantowa (n) określa energię i tworzy powłoki K, L, M, N. Poboczna liczba kwantowa (l) opisuje kształt orbitali: s, p, d, f.
Magnetyczna liczba kwantowa (m) pokazuje orientację orbitali w przestrzeni. Magnetyczna spinowa liczba kwantowa (ms) to kierunek "wirowania" elektronu wokół własnej osi - może być +1/2 lub -1/2.
Zakaz Pauliego mówi, że w atomie nie mogą być dwa identyczne elektrony - każdy musi mieć unikalny "adres"! Na każdej powłoce może być maksymalnie 2n² elektronów: K=2, L=8, M=18.
💡 Przykład: 13Al ma konfigurację K²L⁸M³ - oznacza to 2 elektrony na powłoce K, 8 na L i 3 na M!