Podstawowe właściwości chromu
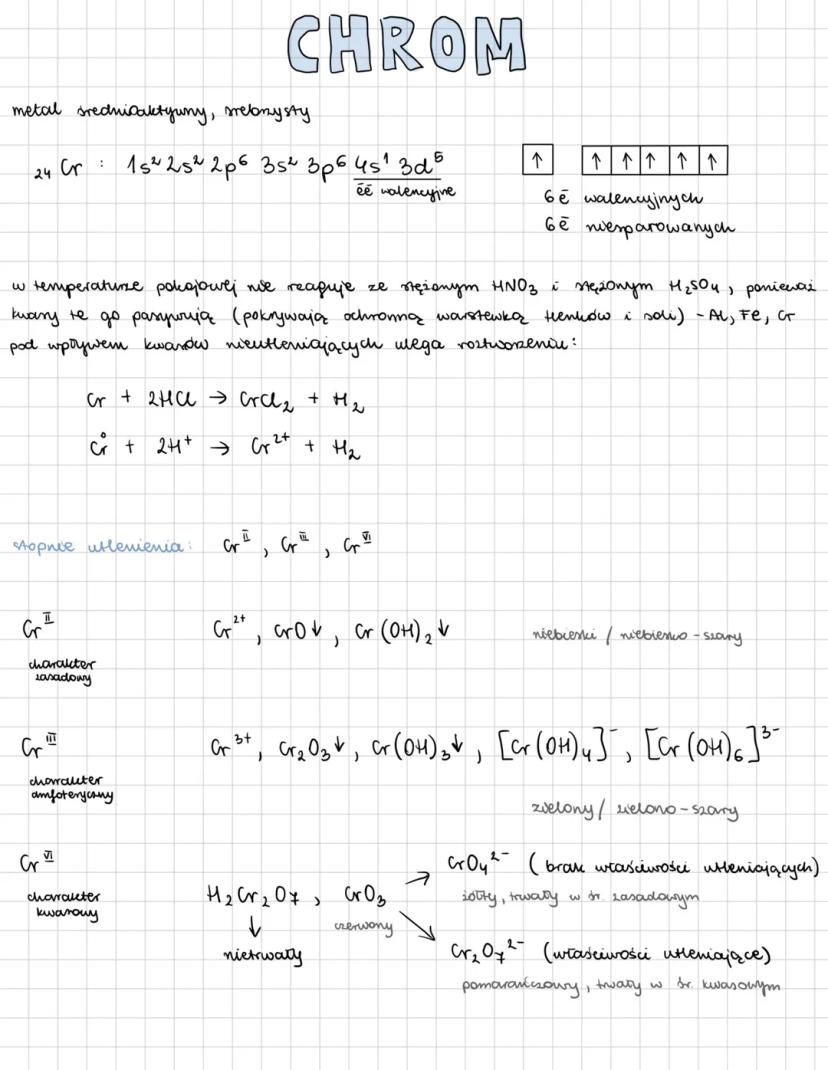
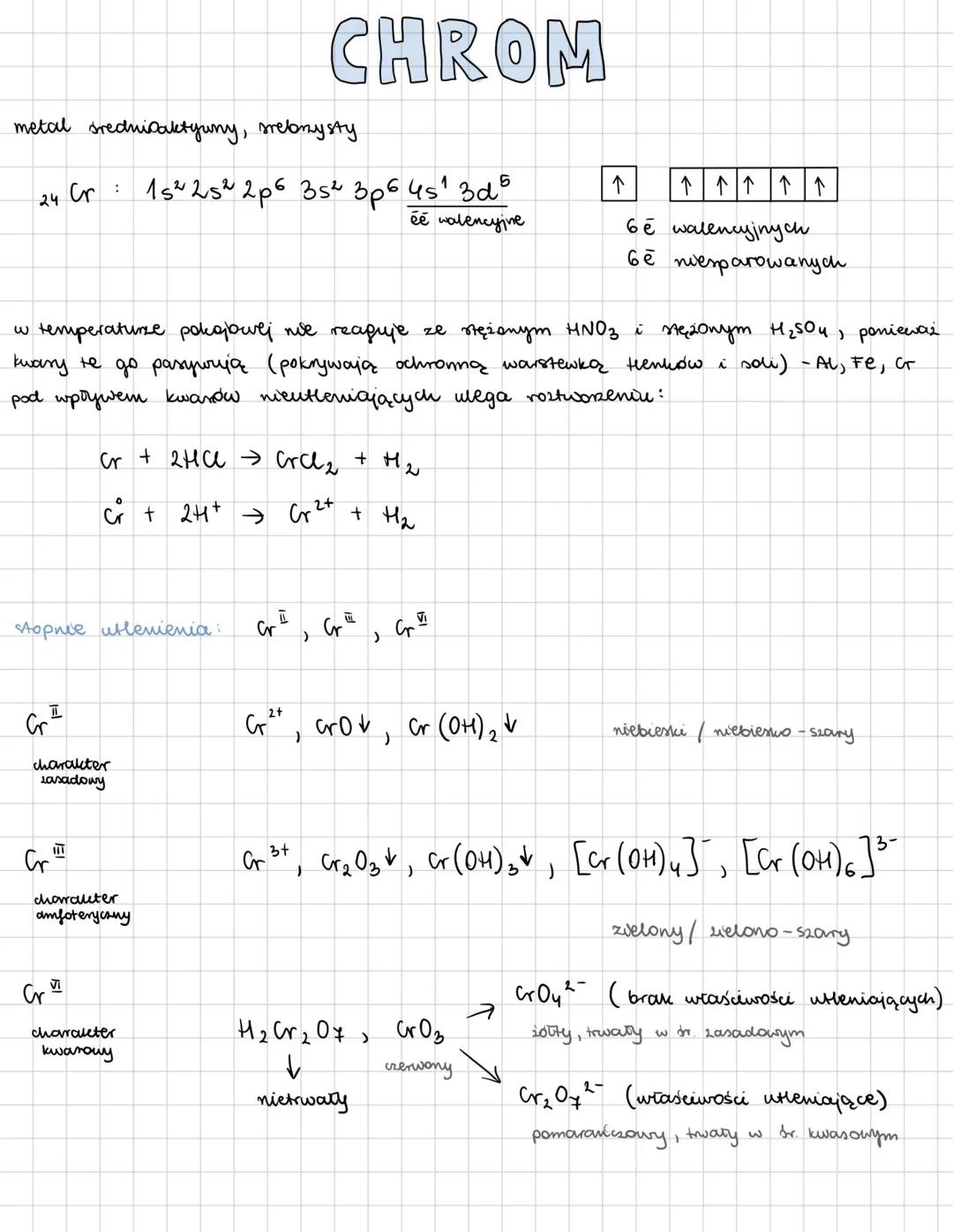
Chrom to metal średnioaktywny o srebrzystym połysku. Posiada 6 elektronów walencyjnych w konfiguracji elektronowej 24Cr: 1s²2s²2p⁶3s²3p⁶4s¹3d⁵. Co ciekawe, w temperaturze pokojowej nie reaguje ze stężonym HNO₃ ani H₂SO₄, ponieważ kwasy te pasywują go, tworząc ochronną warstwę.
Z kwasami nieutleniającymi chrom reaguje, ulegając roztworzeniu: Cr + 2HCl → CrCl₂ + H₂. Metal ten występuje na różnych stopniach utlenienia: Cr⁰, Cr²⁺, Cr³⁺, Cr⁶⁺, przy czym każdy z nich ma inny charakter chemiczny.
Stopień Cr²⁺ ma charakter zasadowy i tworzy związki o niebieskim zabarwieniu. Cr³⁺ wykazuje charakter amfoteryczny i daje zielone związki. Natomiast Cr⁶⁺ ma charakter kwasowy i występuje w formie żółtych chromianów (CrO₄²⁻) trwałych w środowisku zasadowym lub pomarańczowych dichromianów (Cr₂O₇²⁻) trwałych w środowisku kwasowym.
Warto zapamiętać! Związki chromu można często rozpoznać po charakterystycznych barwach: niebieskie (Cr²⁺), zielone (Cr³⁺), żółte (CrO₄²⁻) lub pomarańczowe (Cr₂O₇²⁻).