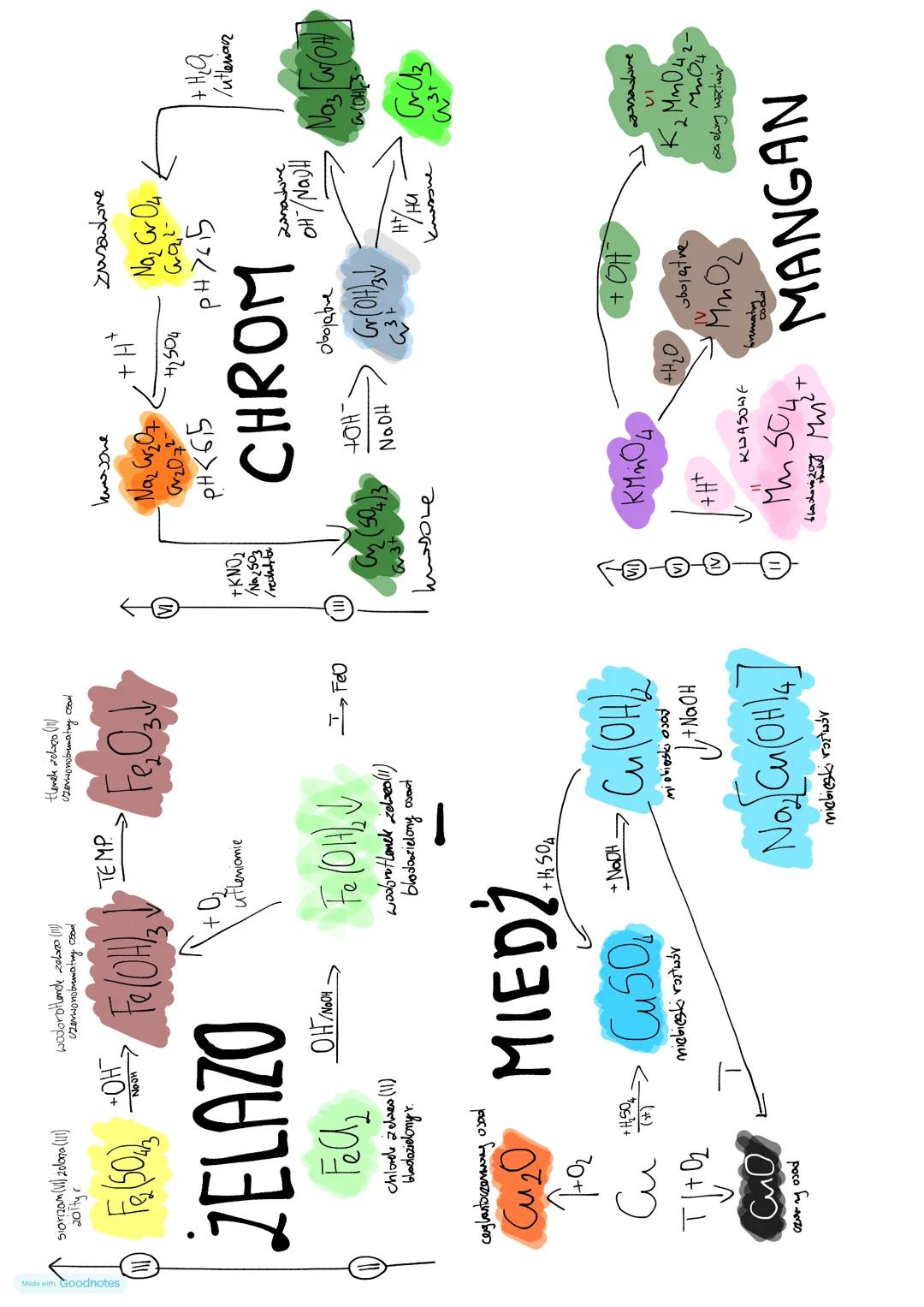
Żelazo - podstawowy metal przemysłowy
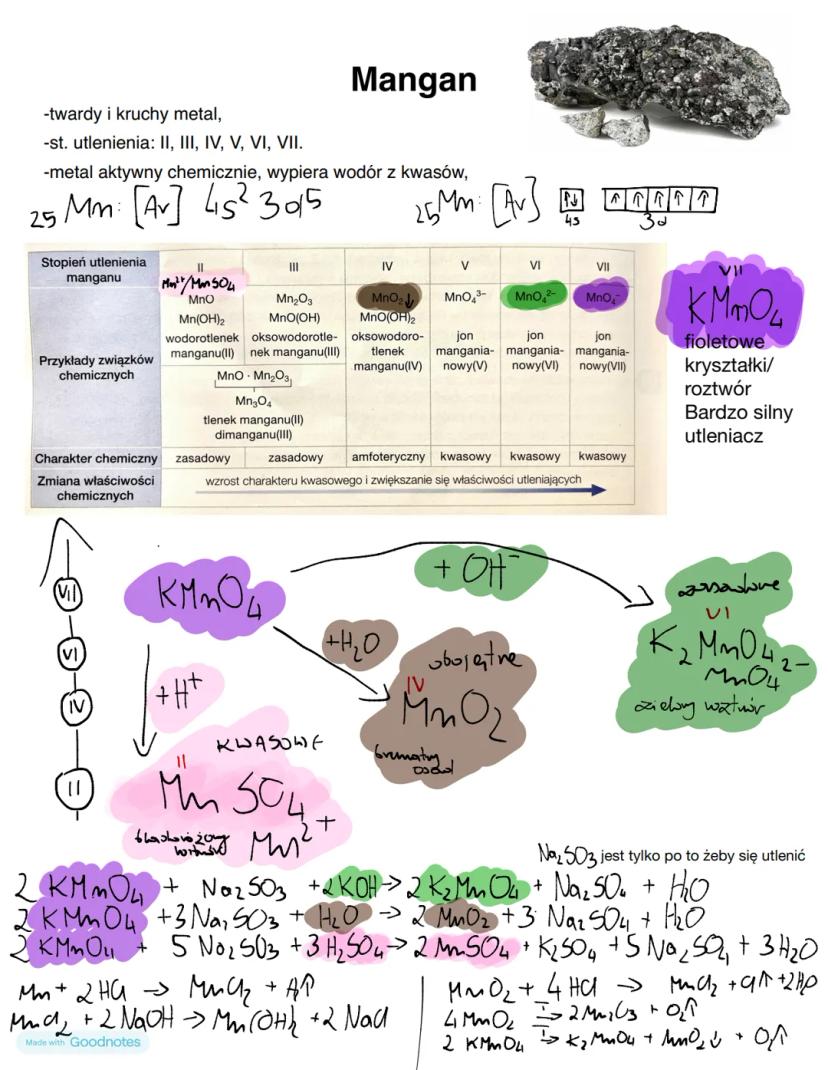
Żelazo to jeden z najważniejszych metali przemysłowych, który występuje głównie na II i III stopniu utlenienia. W zależności od temperatury tworzy cztery odmiany alotropowe, co ma ogromne znaczenie w metalurgii i produkcji stali.
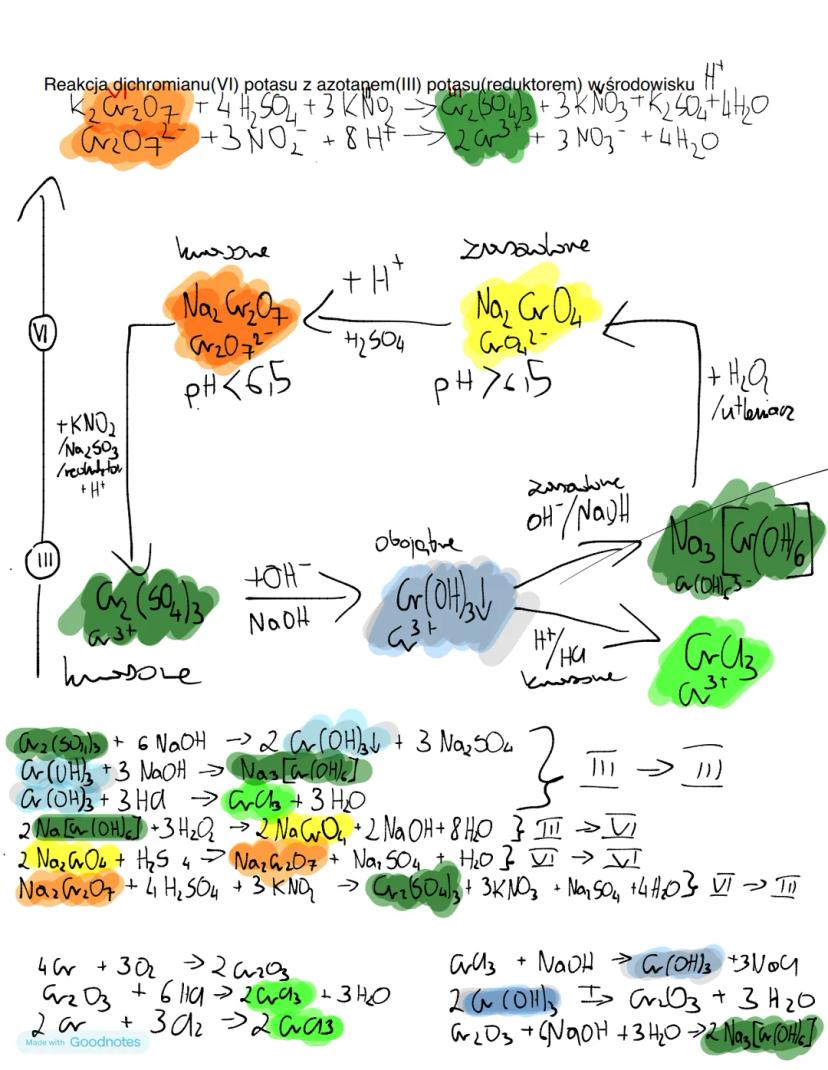
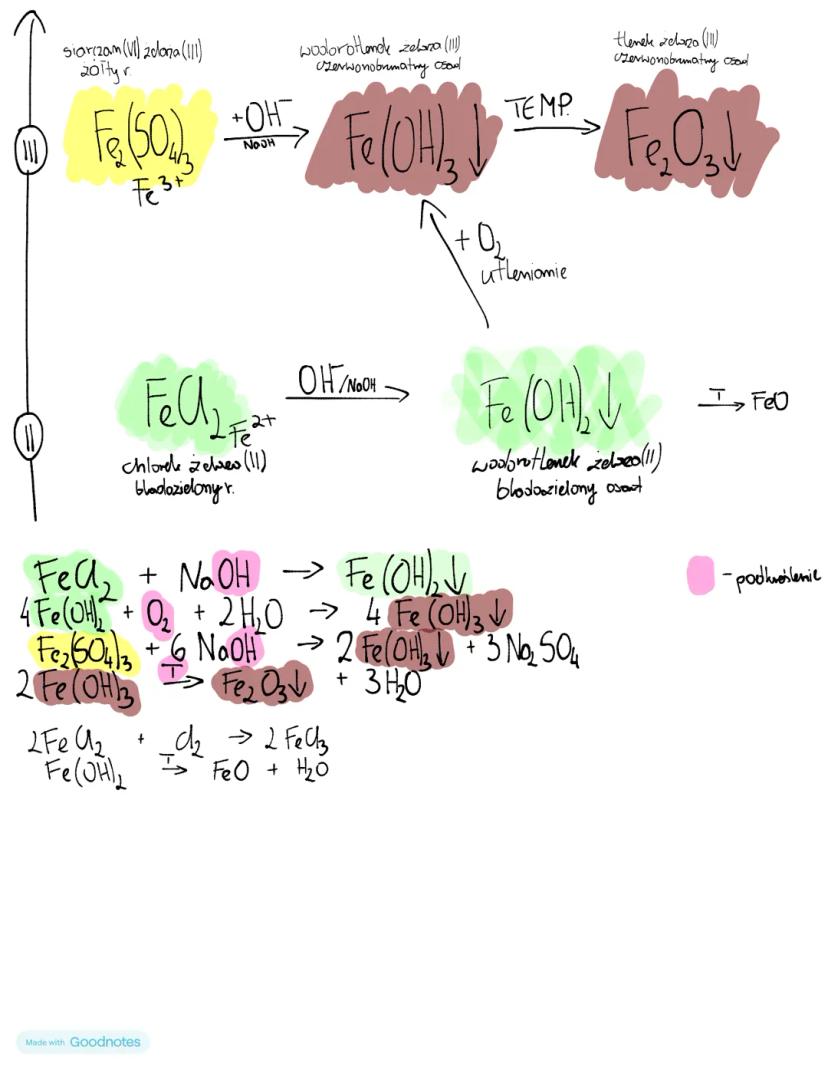
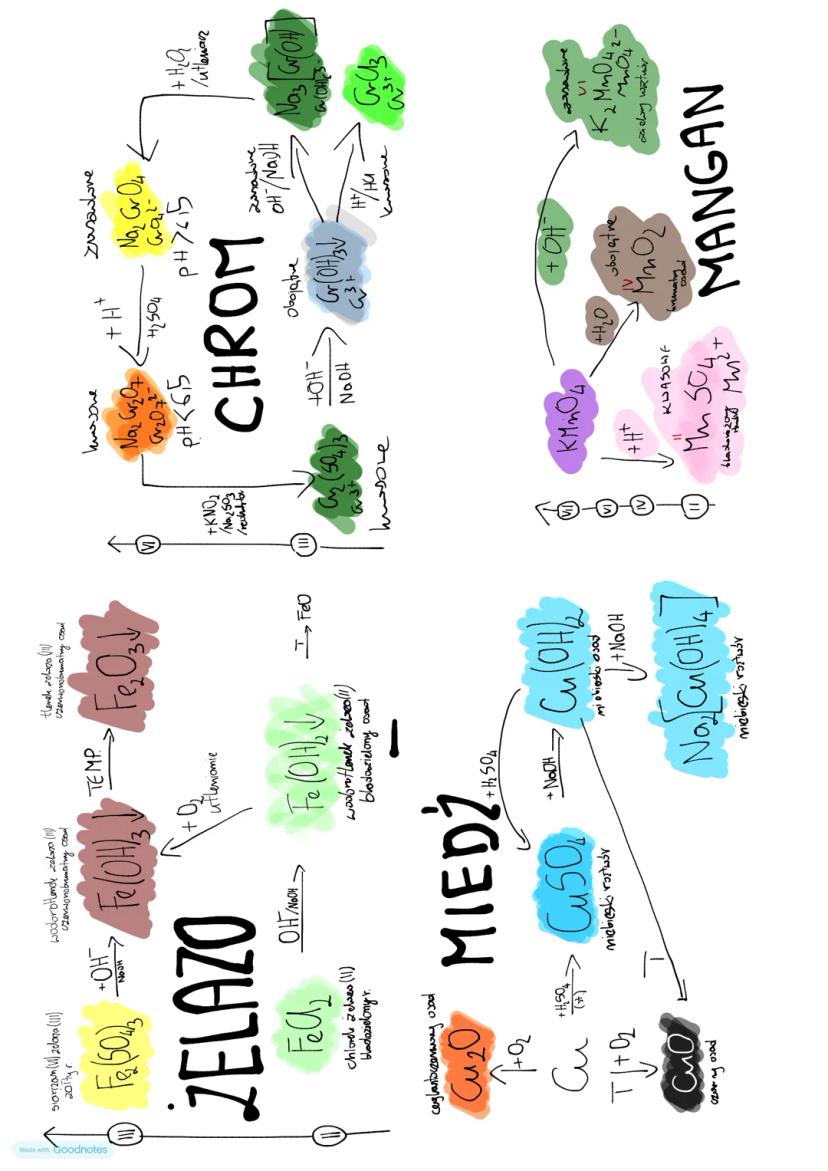
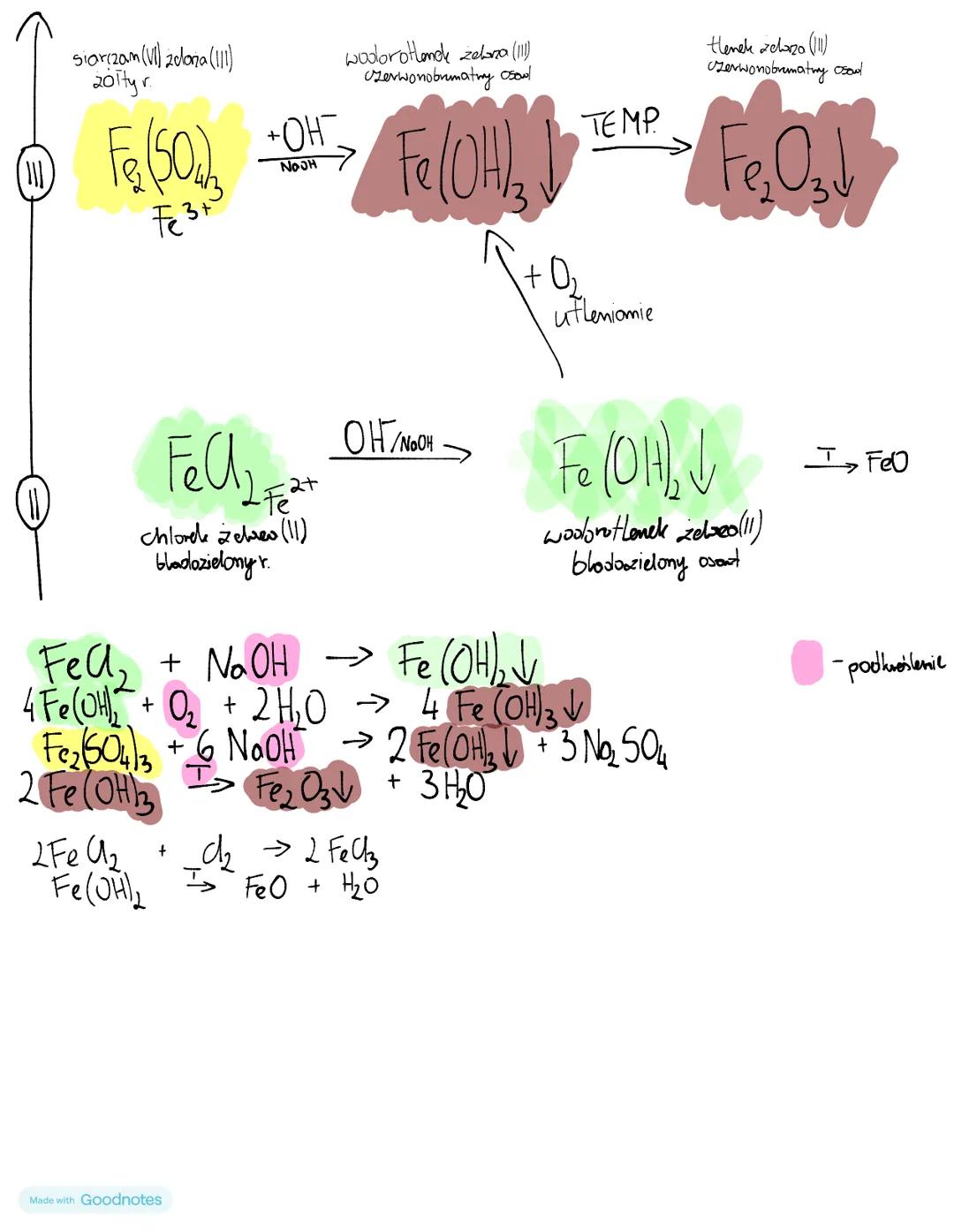
Tlenki i wodorotlenki żelaza (FeO, Fe₂O₃, Fe(OH)₂, Fe(OH)₃) wykazują charakter amfoteryczny, co oznacza, że mogą reagować zarówno z kwasami, jak i zasadami. Żelazo jest dość reaktywne - reaguje z kwasami wypierając wodór np.Fe+2HCl→FeCl2+H2, a także bezpośrednio z chlorem 2Fe+3Cl2→2FeCl3.
Ważnym zjawiskiem jest pasywacja żelaza - reakcja ze stężonymi kwasami utleniającymi (HNO₃, H₂SO₄), która prowadzi do utworzenia warstwy ochronnej tlenku FeO na powierzchni metalu. Ta warstwa chroni żelazo przed dalszym utlenianiem i działaniem czynników zewnętrznych.
W praktyce! Zjawisko pasywacji wykorzystuje się w ochronie antykorozyjnej konstrukcji stalowych. Chociaż rdza (tlenek żelaza) może zniszczyć stal, to odpowiednio wytworzona warstwa pasywacyjna może skutecznie chronić metal przed zniszczeniem.