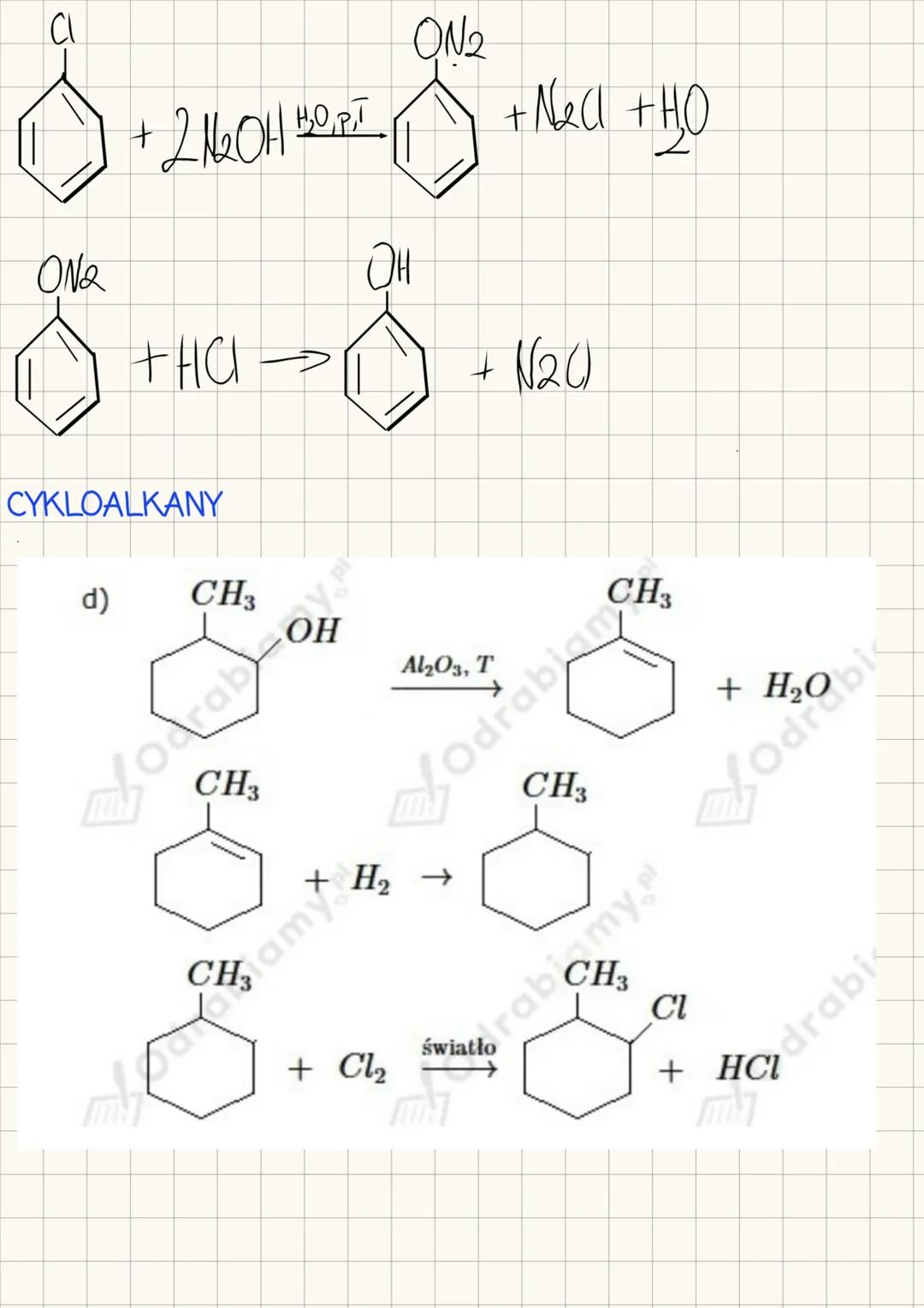
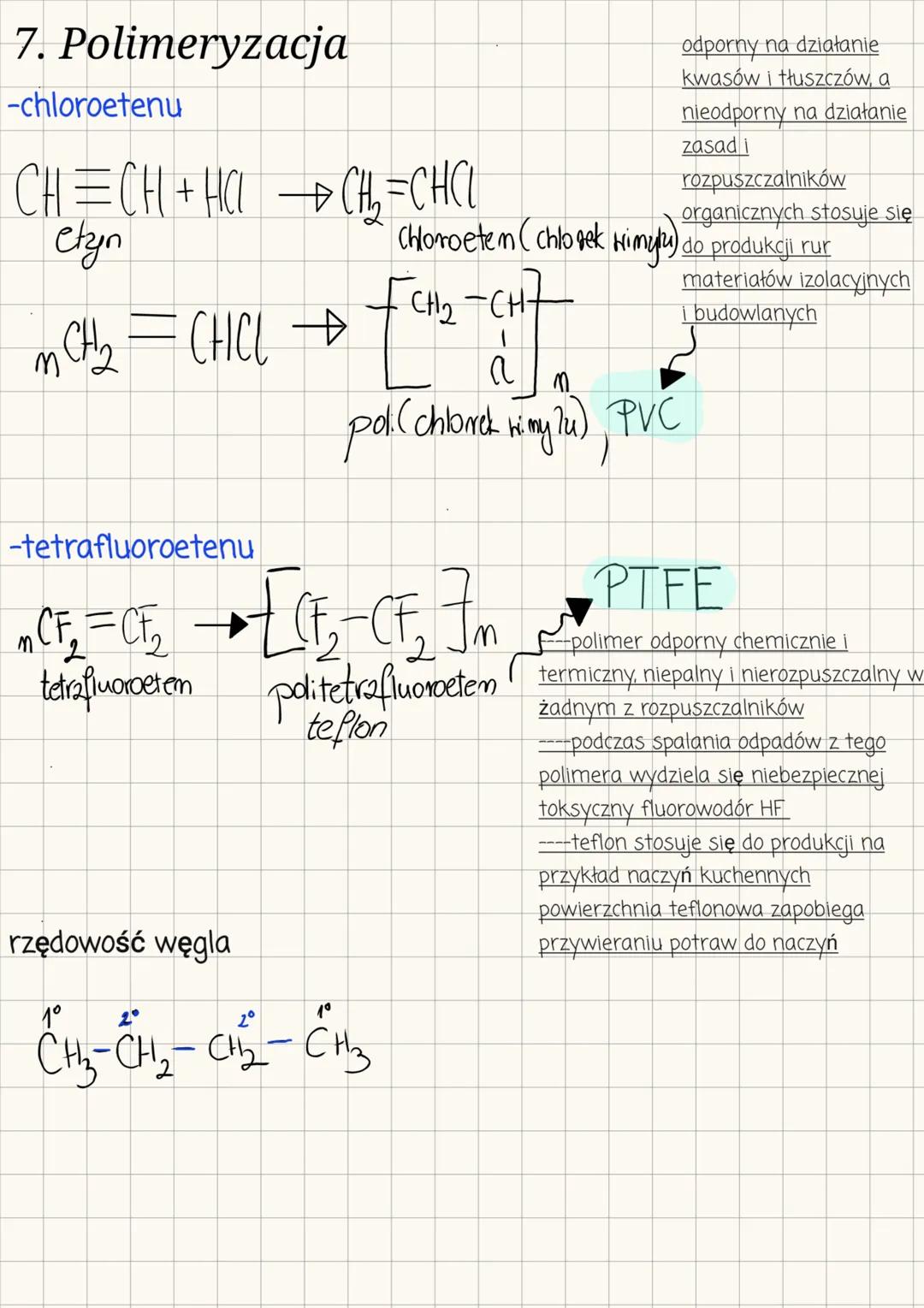
Właściwości fluorowcopochodnych
Właściwości fluorowcopochodnych zależą od ich masy cząsteczkowej - im większa masa, tym wyższa temperatura wrzenia. Najczęściej są to niepalne ciecze, nierozpuszczalne w wodzie, choć istnieją wyjątki - niektóre lżejsze związki występują jako gazy (np. CH₃F, CH₃Cl, CH₃Br).
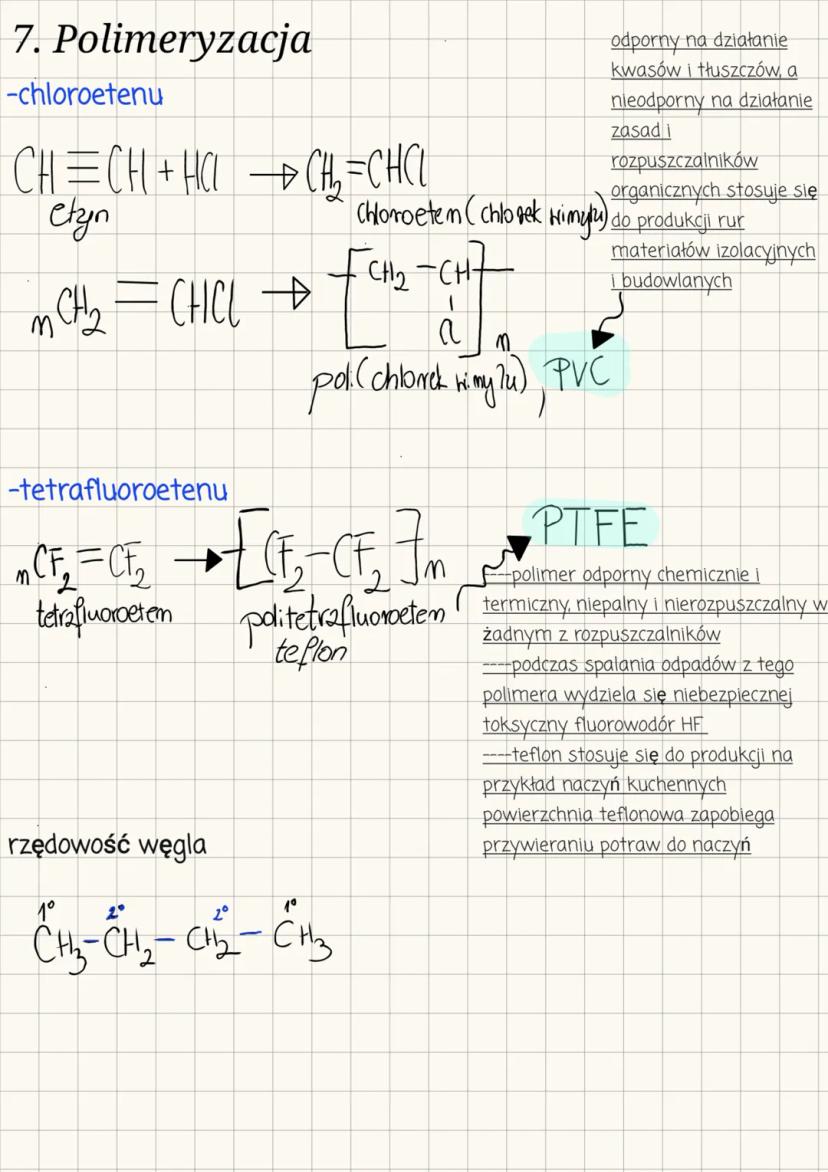
Fluorowcopochodne łatwo rozpuszczają się w niepolarnych rozpuszczalnikach. Wykazują wysoką reaktywność chemiczną ze względu na spolaryzowane wiązanie C-X węgiel−fluorowiec, co prowadzi do tego, że związki te są polarne i mają niezerowy moment dipolowy.
⚠️ Uwaga! Wiązanie C-X jest spolaryzowane, z ładunkiem δ+ na atomie węgla i δ- na atomie fluorowca, co sprawia, że atom węgla może być atakowany przez czynniki nukleofilowe.
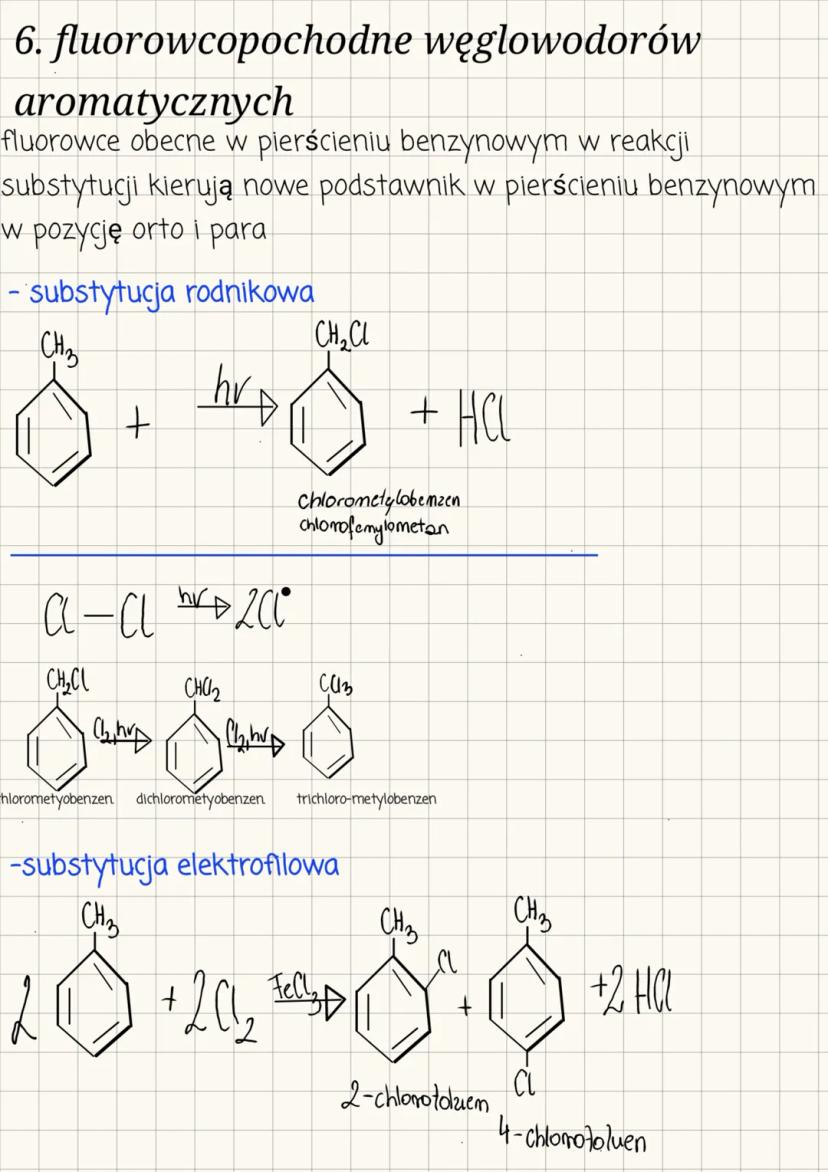
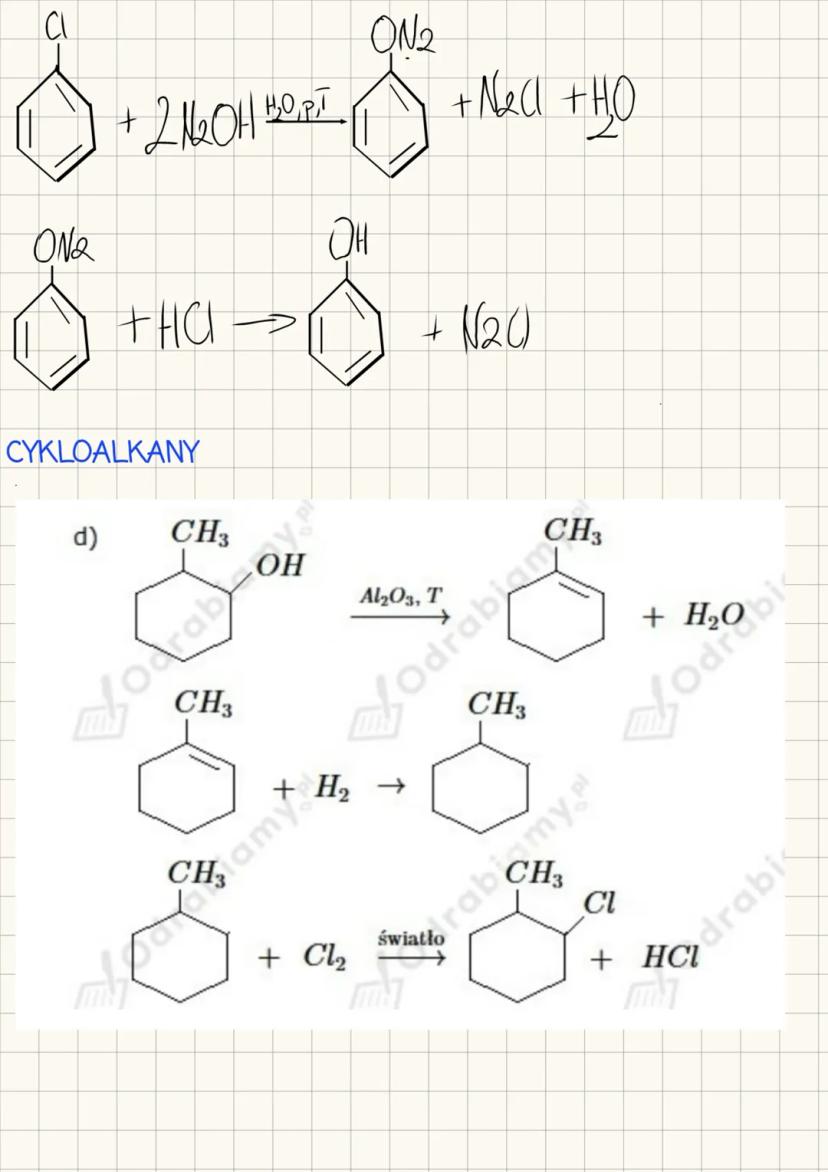
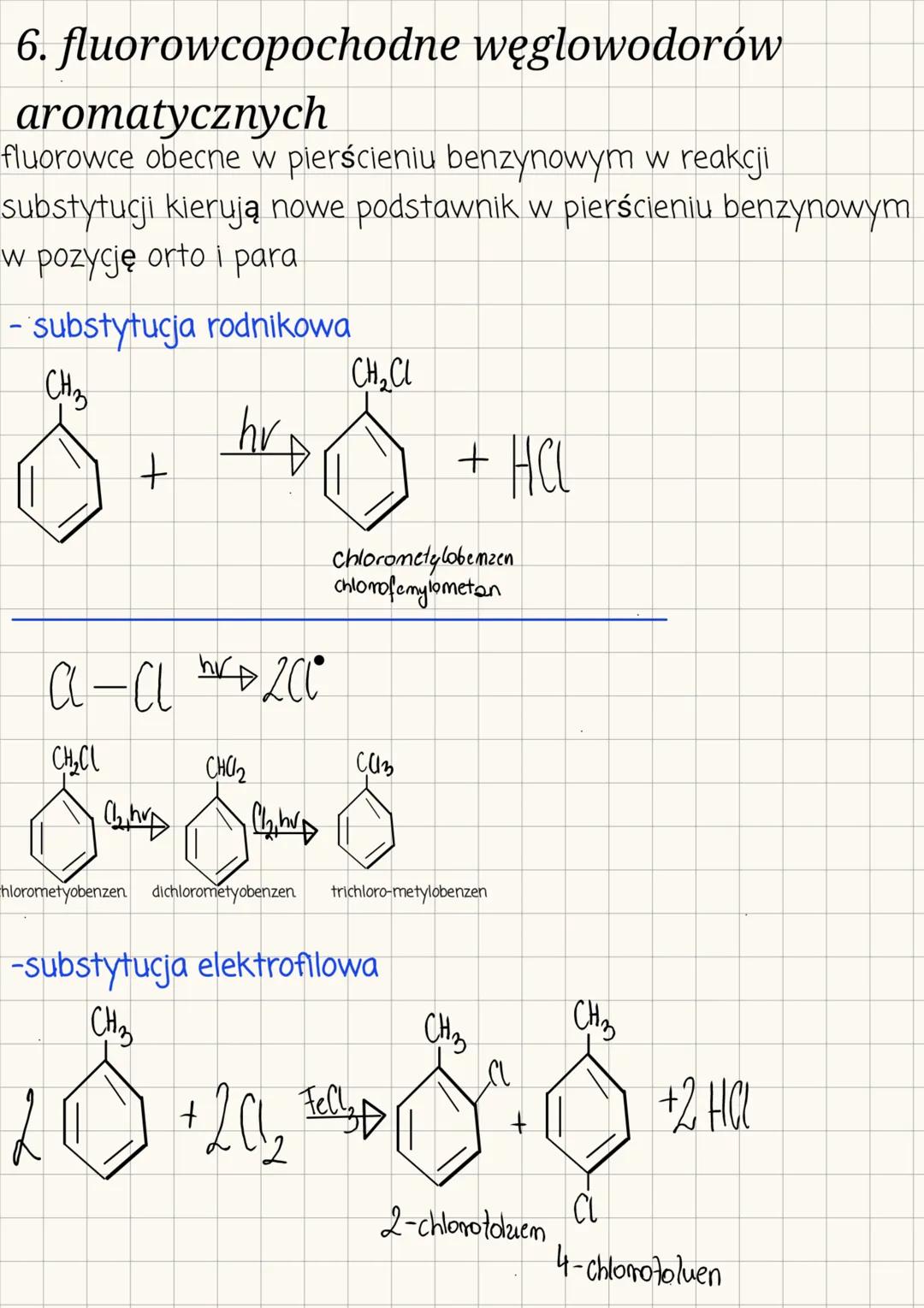
Przykłady fluorowcopochodnych aromatycznych to 4-chlorotoluen i 1,6-dichloronaftalen, które zachowują specyficzne właściwości związków aromatycznych, jednocześnie zyskując nowe właściwości dzięki obecności atomów fluorowców.