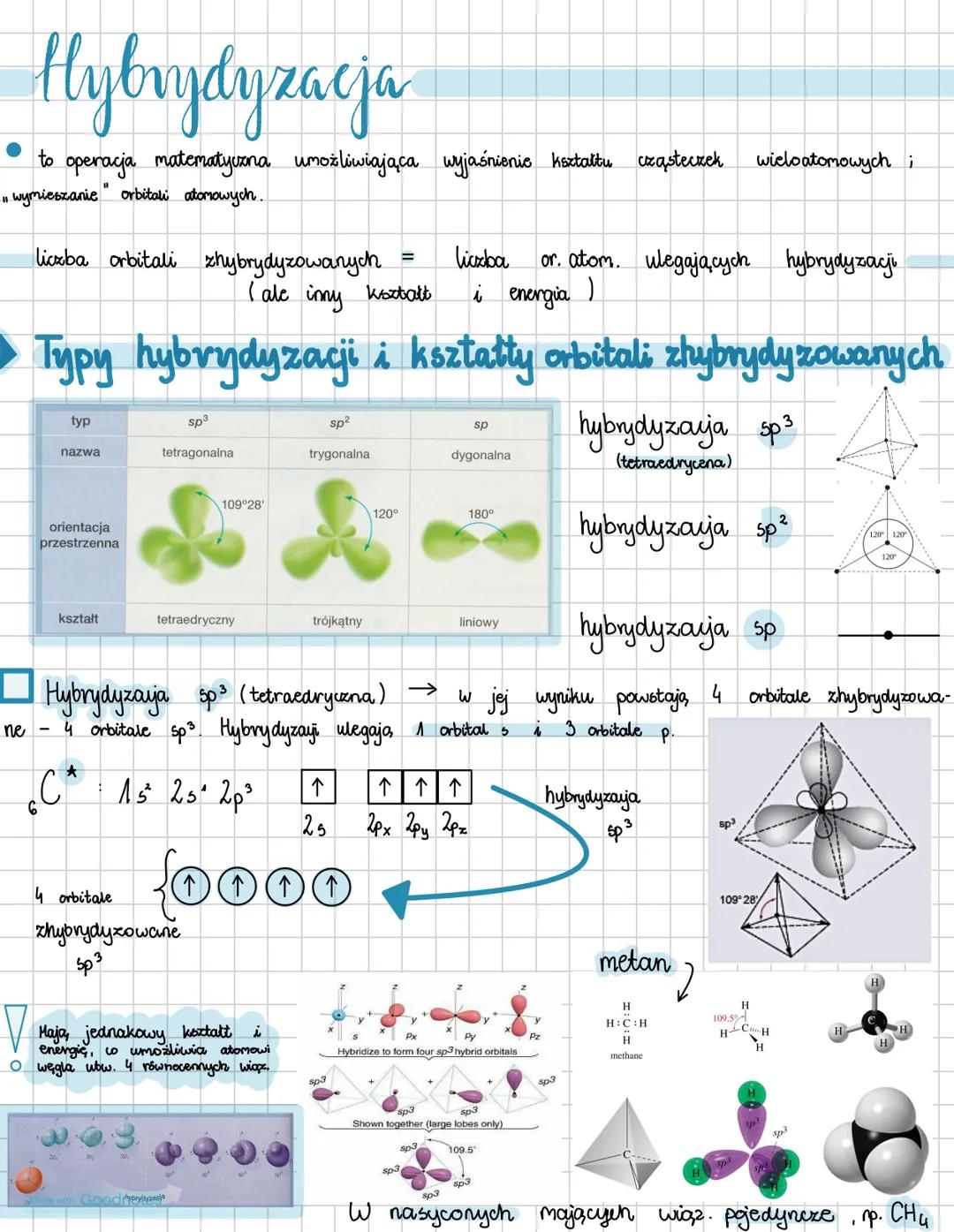
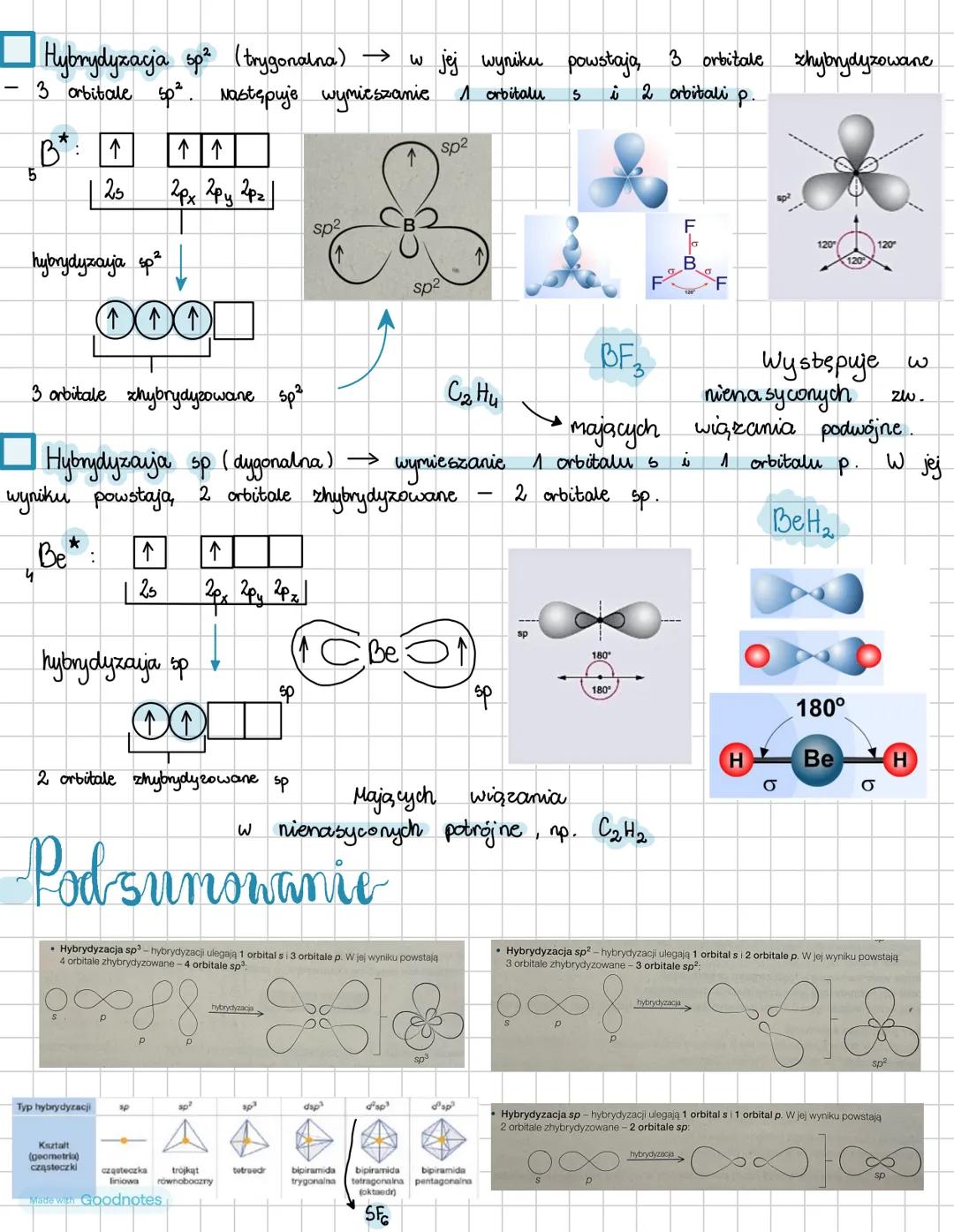
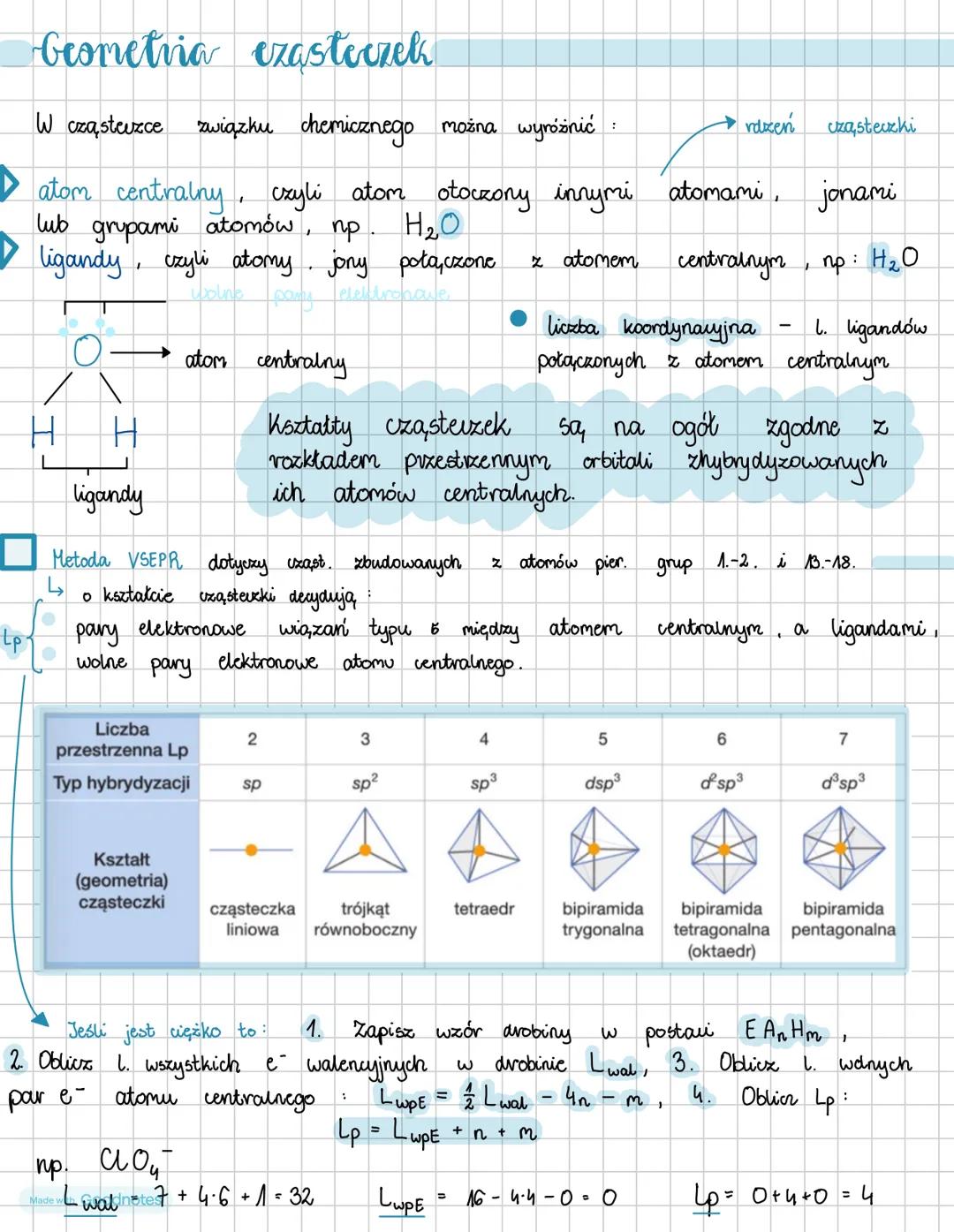
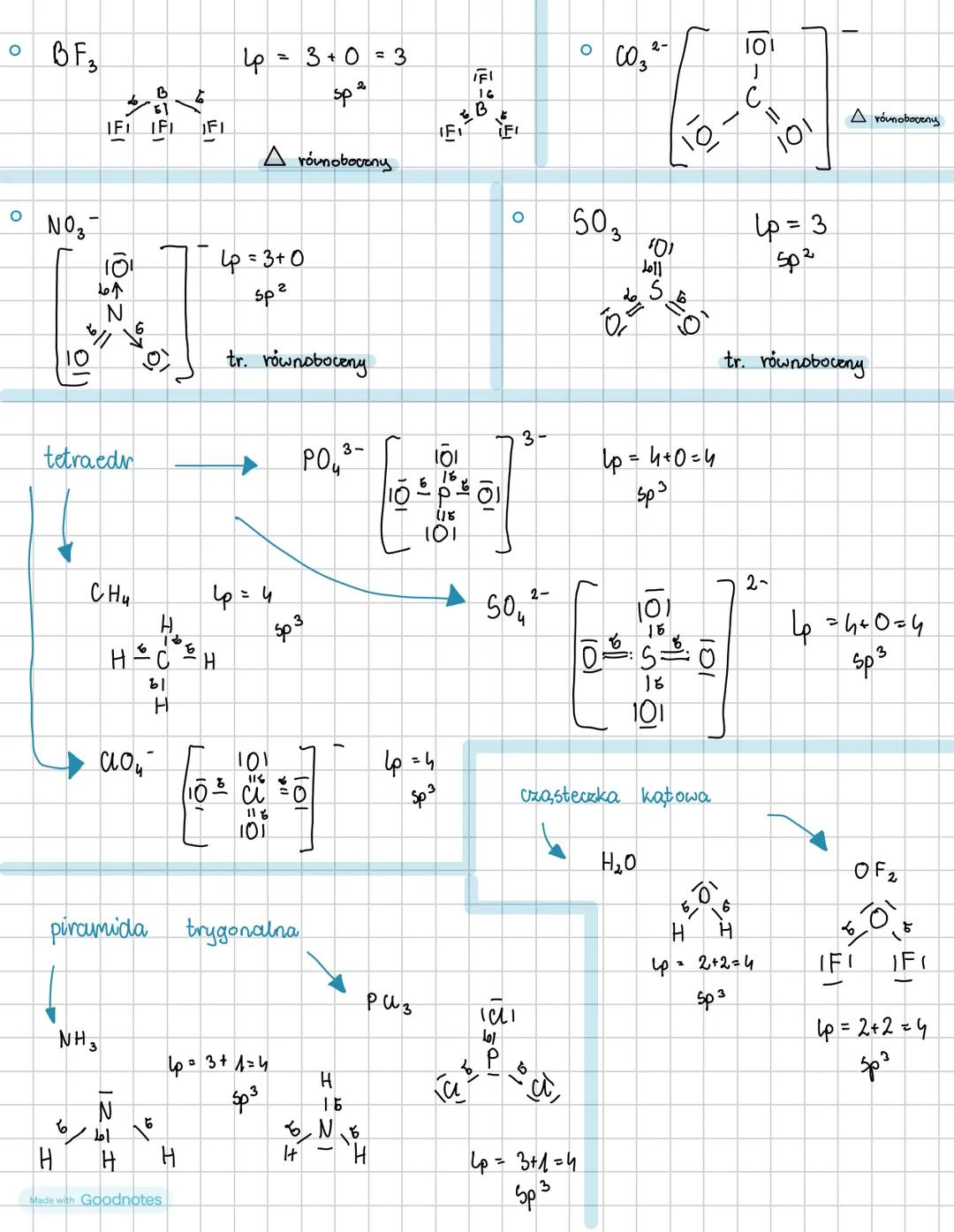
Więcej przykładów hybrydyzacji
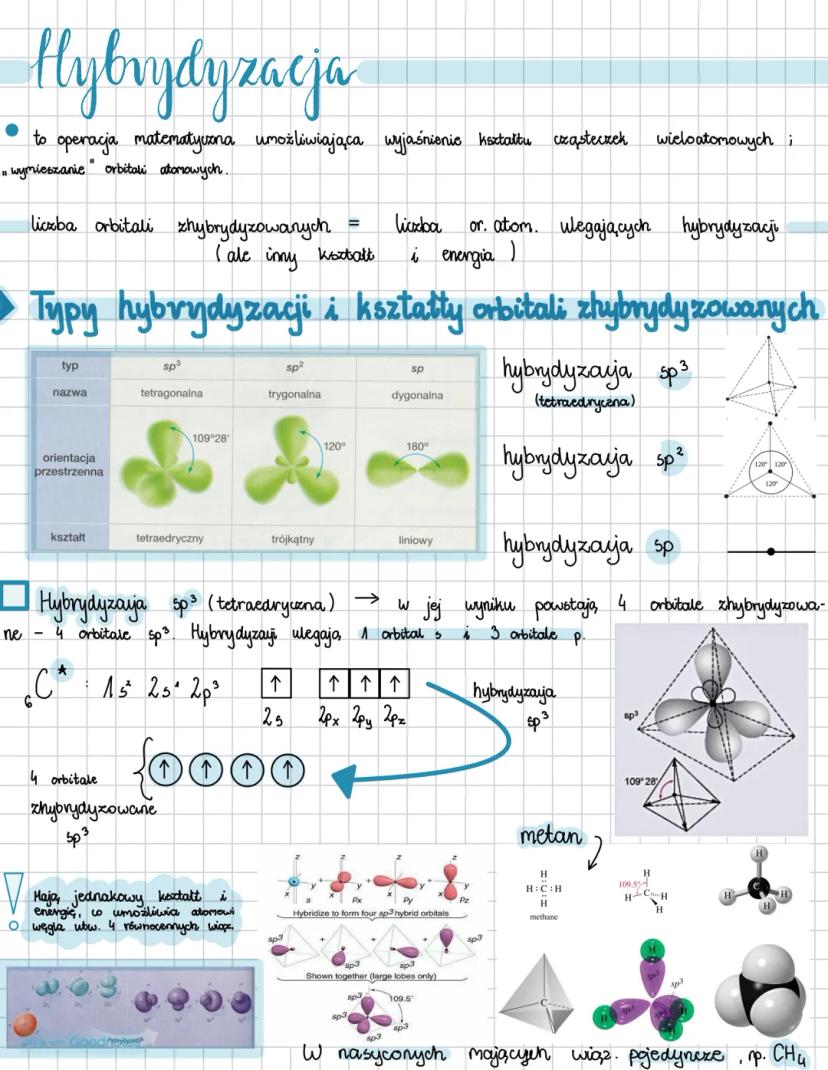
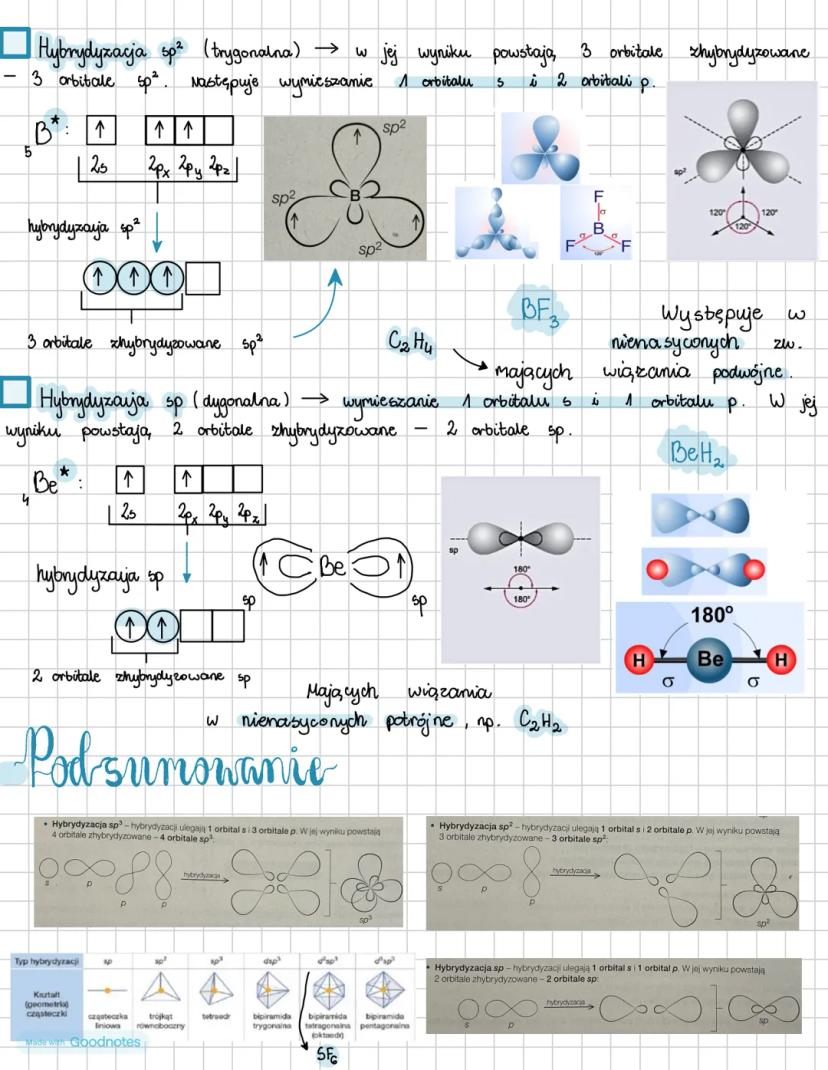
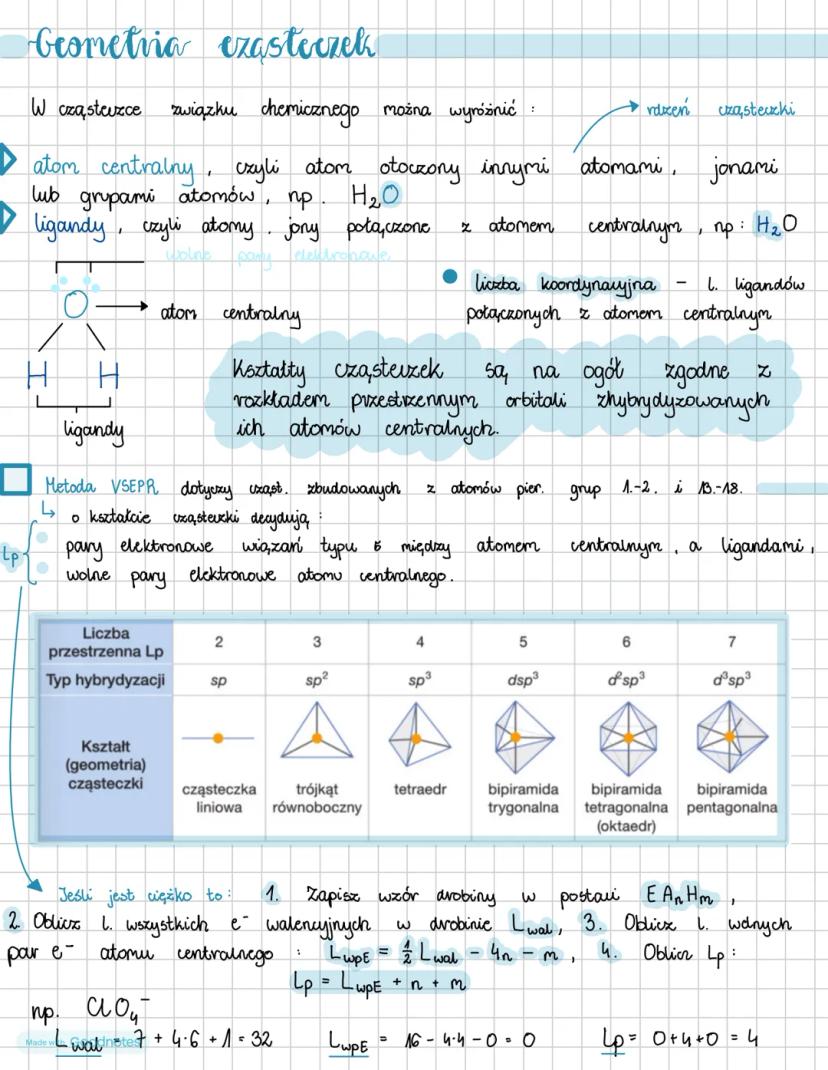
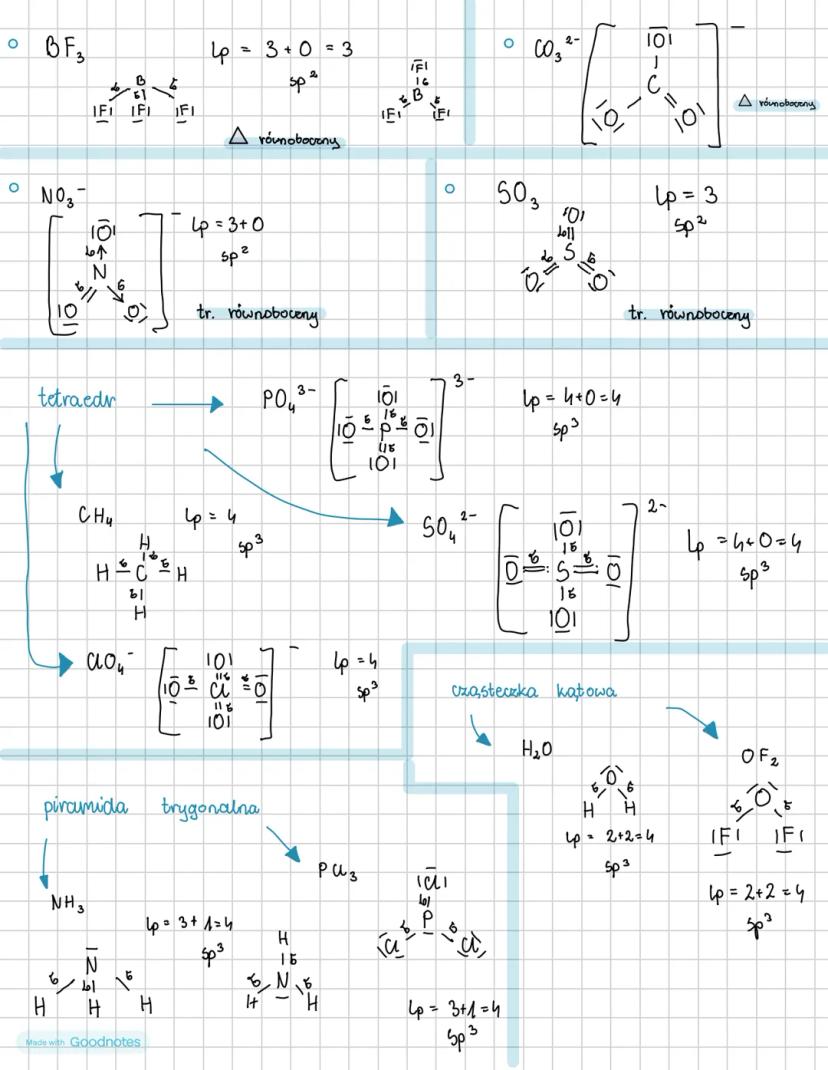
Zobaczmy więcej przykładów określania hybrydyzacji i geometrii cząsteczek:
BF₃: Lp = 3 + 0 = 3, hybrydyzacja sp², kształt trójkąta równobocznego. Wszystkie atomy leżą w jednej płaszczyźnie.
NO₃⁻: Lp = 3 + 0 = 3, hybrydyzacja sp², kształt trójkąta równobocznego. Jon azotanowy jest płaski.
CH₄: Lp = 4 + 0 = 4, hybrydyzacja sp³, kształt tetraedru. Każdy kąt H-C-H wynosi 109°28'.
CO₃²⁻: Lp = 3 + 0 = 3, hybrydyzacja sp², kształt trójkąta równobocznego. Jon węglanowy jest płaski.
H₂O: Lp = 2 + 2 = 4, hybrydyzacja sp³, cząsteczka kątowa. Dwie wolne pary elektronów na atomie tlenu zmieniają idealny kształt tetraedru na kątowy.
NH₃: Lp = 3 + 1 = 4, hybrydyzacja sp³, kształt piramidy trygonalnej. Jedna wolna para elektronów na atomie azotu.
Ważne: Płaskie cząsteczki powstają zawsze przy hybrydyzacji sp i sp², natomiast przy sp³ cząsteczka jest przestrzenna (tetraedr) lub może być kątowa (gdy są wolne pary elektronowe).