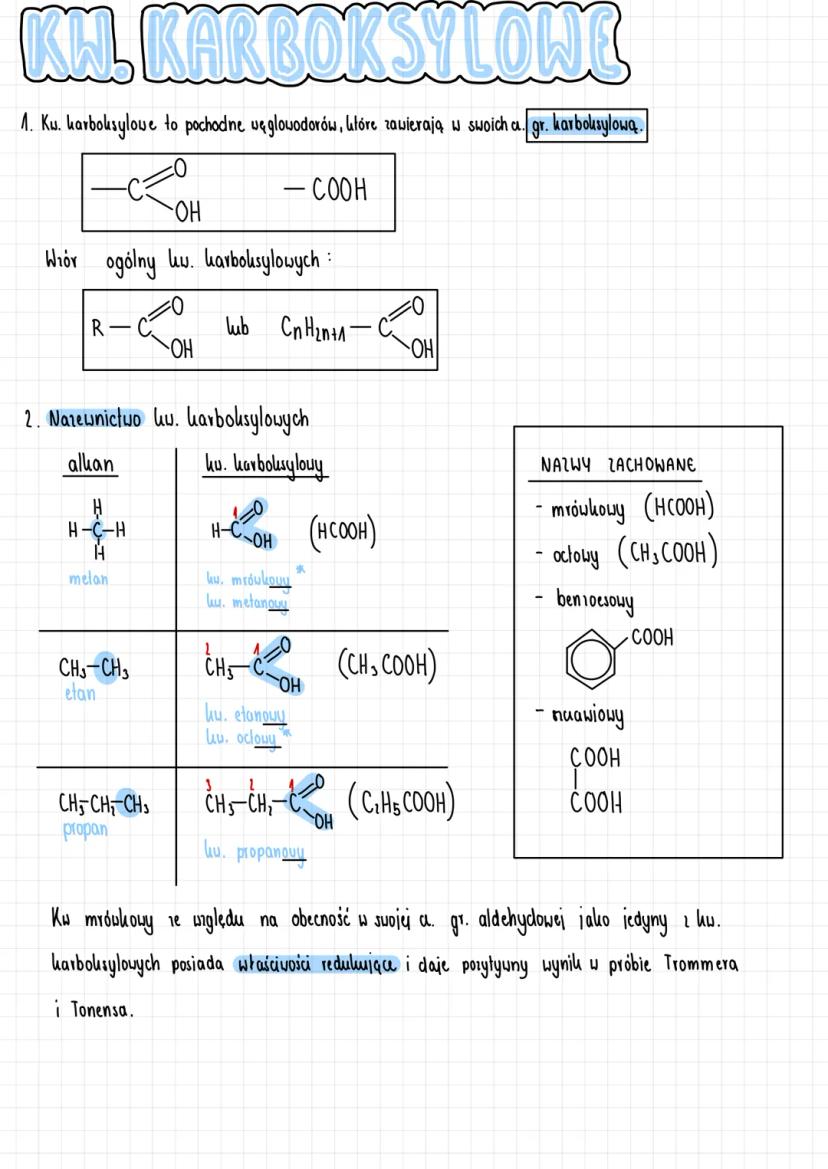
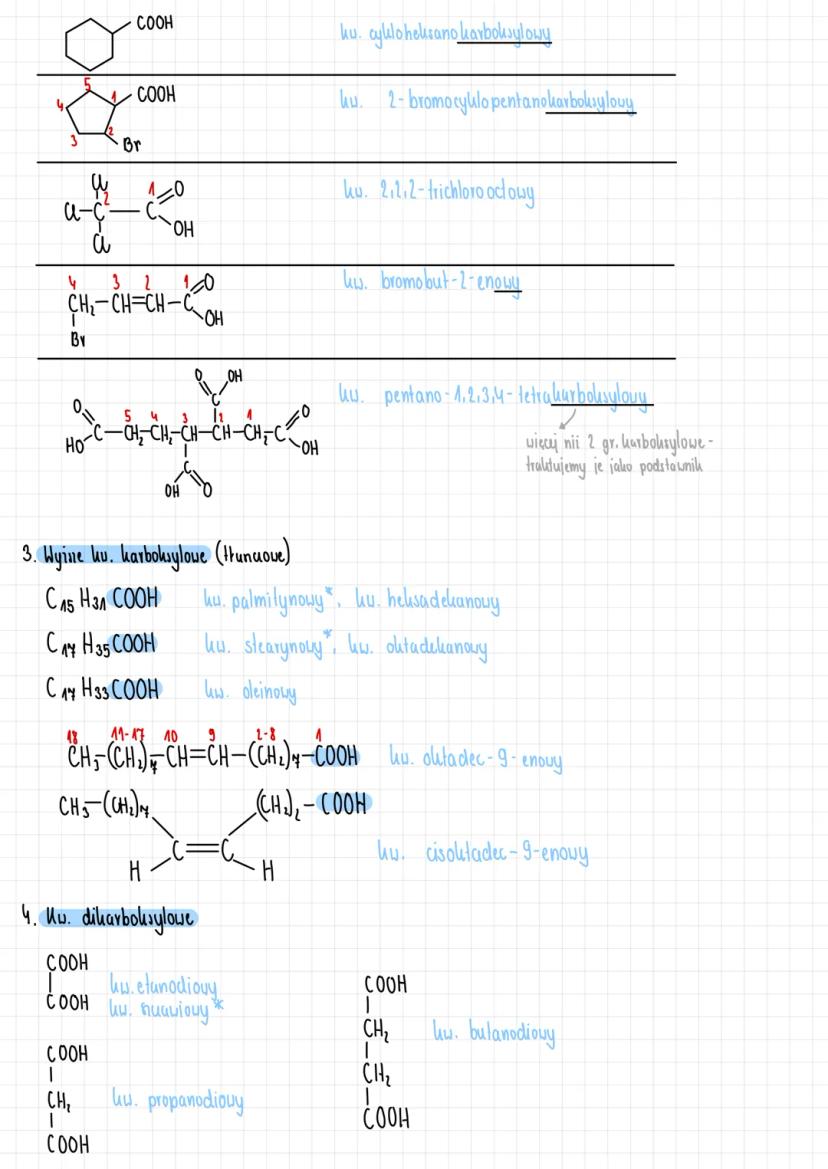
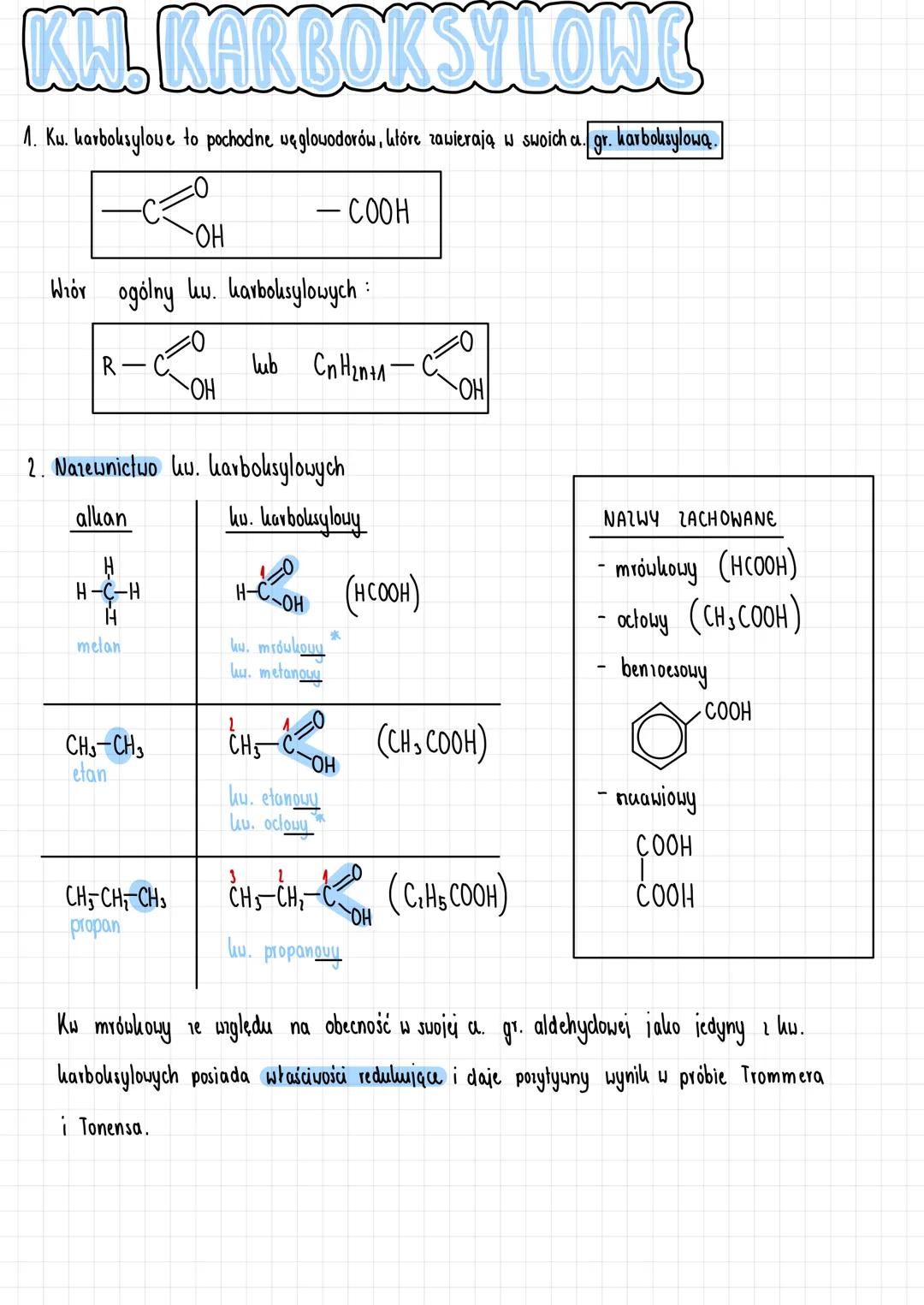
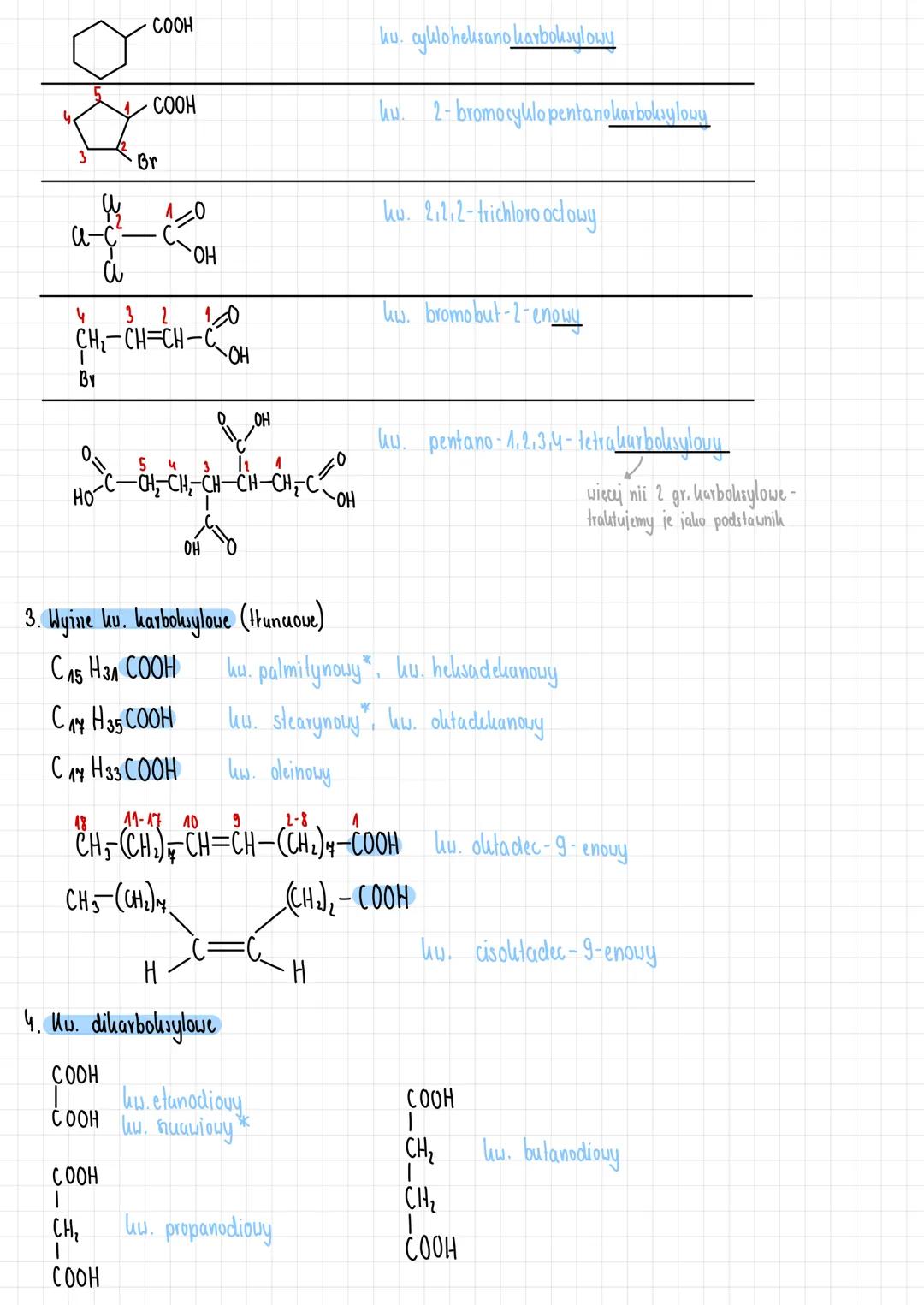
Właściwości fizyczne
Stany skupienia w 25°C: C₁-C₉ to ciecze, C₁₀-C₁₂ to ciała stałe. Wraz ze wzrostem masy cząsteczkowej rosną temperatury wrzenia i topnienia oraz gęstość.
Rozpuszczalność w wodzie maleje wraz z wydłużaniem łańcucha. Pierwsze cztery kwasy (mrówkowy, octowy, propanowy, butanowy) mieszają się z wodą w każdym stosunku. Wynika to z tworzenia wiązań wodorowych.
Kwasy karboksylowe mają lepszą rozpuszczalność niż alkohole o podobnej budowie. Mogą tworzyć więcej wiązań wodorowych dzięki obecności zarówno atomu tlenu w grupie karbonylowej, jak i grupy -OH.
Wiązania wodorowe międzycząsteczkowe powodują, że kwasy mają wyższe temperatury wrzenia i topnienia niż odpowiadające im alkany. To dlatego kwas octowy wrze w 118°C, a etan w -89°C.
💡 Ciekawostka: Grupa karboksylowa jest hydrofilowa (przyciąga wodę), a łańcuch węglowy hydrofobowy (odpycha wodę) - to decyduje o rozpuszczalności.