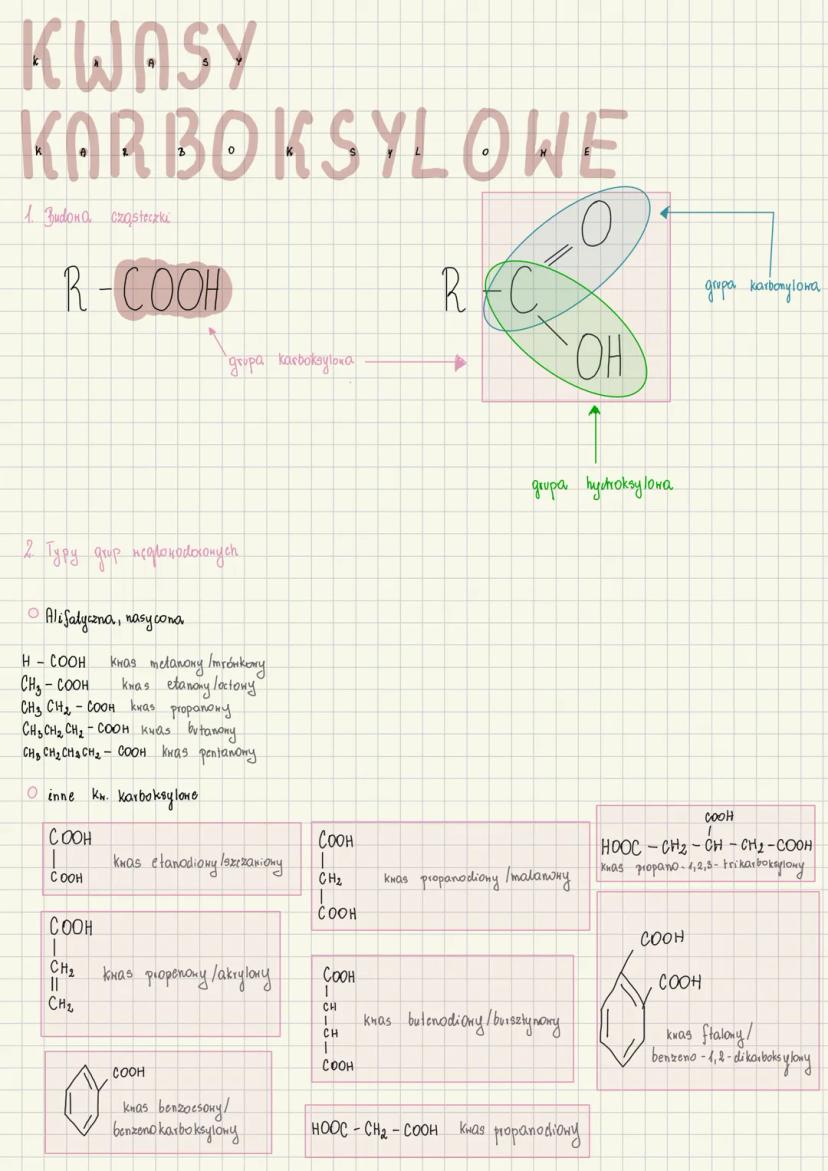
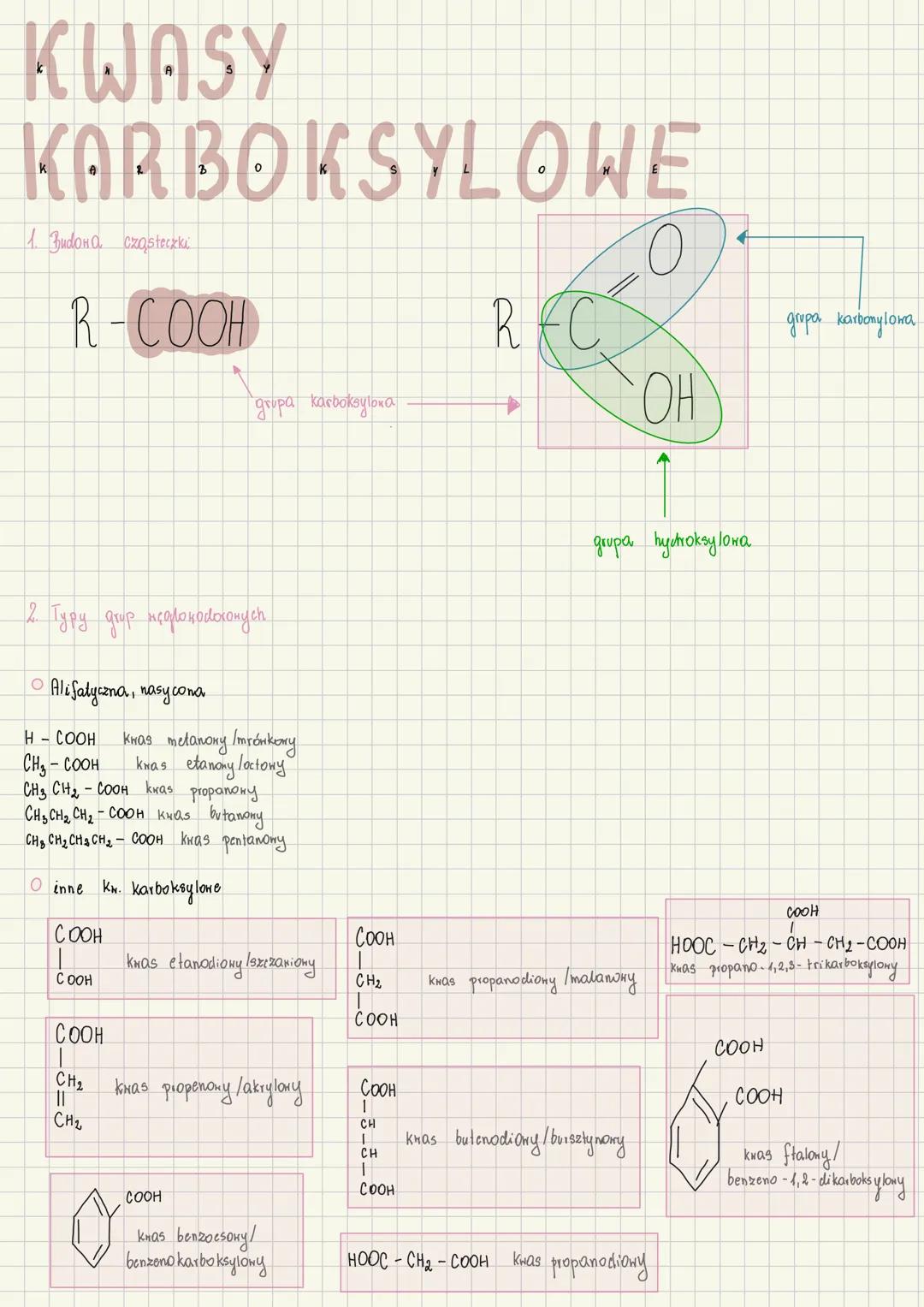
Właściwości kwasu metanowego (mrówkowego)
Kwas metanowy (mrówkowy) posiada wyjątkowe właściwości ze względu na obecność grupy aldehydowej H−C=O w swojej strukturze. Dzięki niej wykazuje słabe właściwości redukujące, które można potwierdzić działaniem silnych utleniaczy, takich jak KMnO₄ czy K₂Cr₂O₇ w środowisku kwaśnym:
5HCOOH + 2KMnO₄ + 3H₂SO₄ → 2MnSO₄ + 5CO₂ + 8H₂O + K₂SO₄
Ciekawostką jest fakt, że kwas mrówkowy, mimo posiadania grupy aldehydowej, nie daje pozytywnych wyników w próbach Tollensa i Trommera. Dzieje się tak, ponieważ w zasadowym środowisku tych prób zachodzi reakcja:
- HCOOH + NaOH → HCOONa + H₂O
Kwas metanowy można otrzymać na kilka sposobów:
- Z tlenku węgla: CO + NaOH → HCOONa, następnie 2HCOONa + H₂SO₄ → 2HCOOH + Na₂SO₄
- Przez utlenianie metanu: 2CH₄ + 3O₂ → 2HCOOH + 2H₂O (w obecności katalizatora, w odpowiedniej temperaturze i ciśnieniu)
🧪 Eksperyment! W laboratorium możesz rozpoznać kwas mrówkowy dzięki jego charakterystycznemu zapachowi i reakcji z AgNO₃, która przebiega inaczej niż w przypadku innych kwasów karboksylowych.