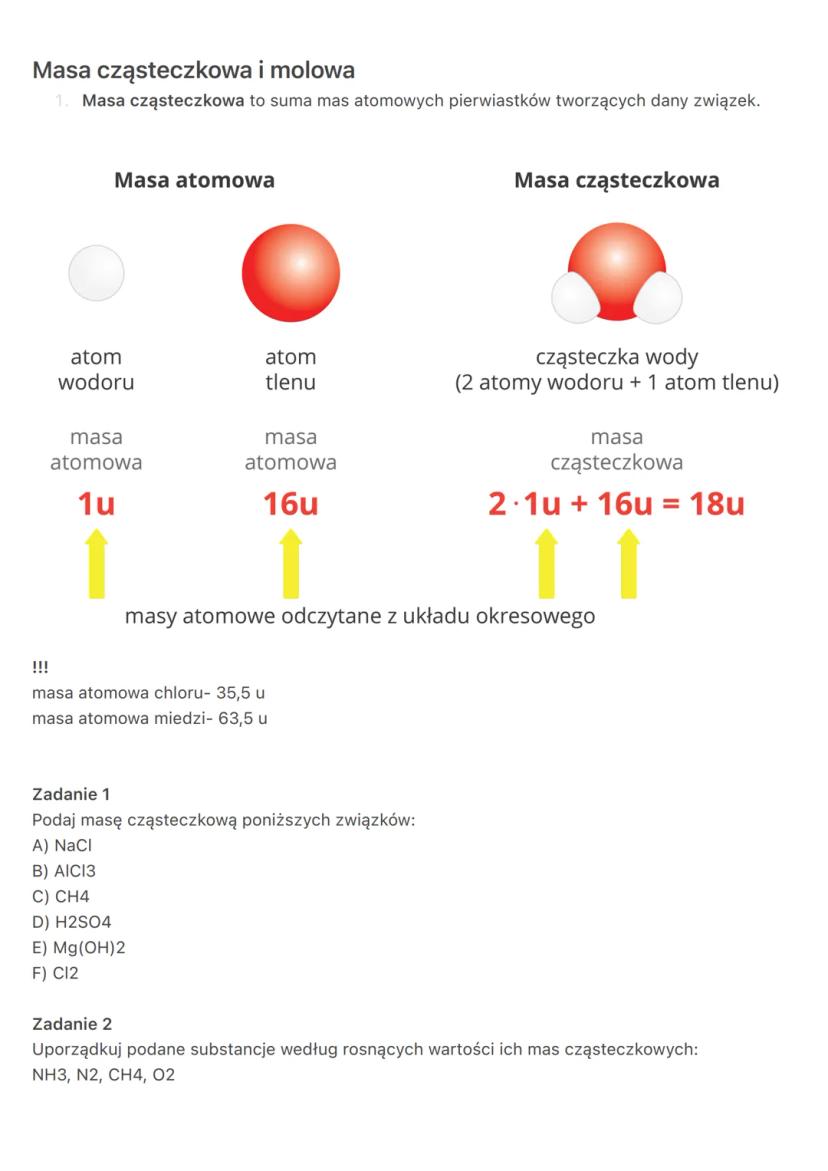
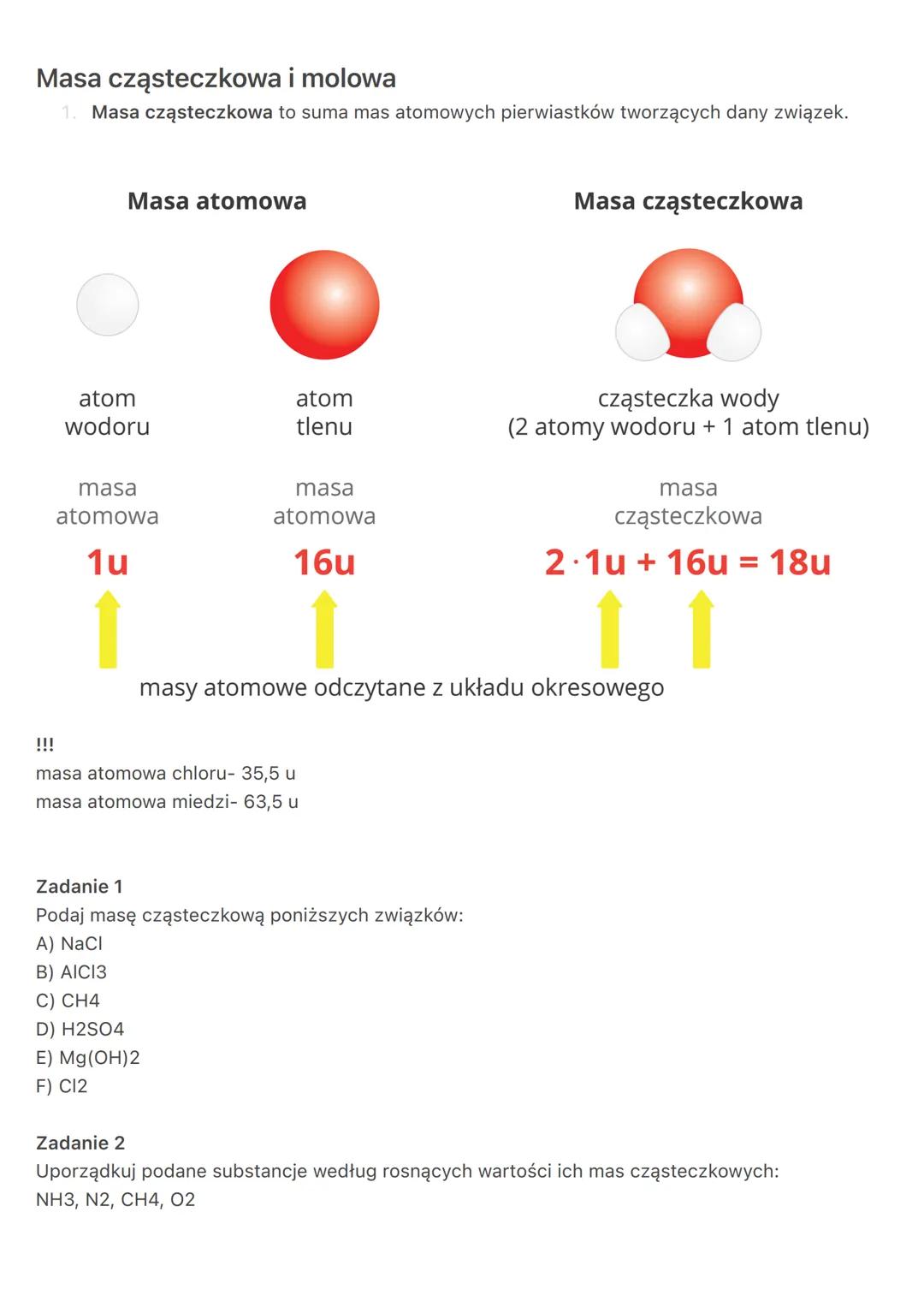
Praktyczne obliczenia molowe
Potrafisz już obliczyć liczbę moli znając masę substancji. Dla 9g wody obliczamy: n = m/M = 9g/18g/mol = 0,5 mol. Oznacza to, że 9 gramów wody zawiera pół mola cząsteczek H₂O.
Możesz też obliczyć liczbę moli znając liczbę cząstek. Na przykład, 3,01·10²³ atomów siarki to n = N/Nₐ = 3,01·10²³/6,02·10²³ = 0,5 mola. Ta metoda jest przydatna, gdy znamy ilość cząstek zamiast masy substancji.
Te obliczenia są podstawą do rozwiązywania bardziej złożonych problemów stechiometrycznych w chemii. Pamiętaj, że mol to po prostu sposób liczenia bardzo małych cząstek - podobnie jak tuzin oznacza 12 czegoś, mol oznacza 6,02·10²³ czegoś.
Ciekawostka! Liczba Avogadra jest tak ogromna, że gdybyś miał mol ziarenek piasku, mógłbyś pokryć całą powierzchnię Ziemi warstwą piasku o grubości kilkudziesięciu metrów!