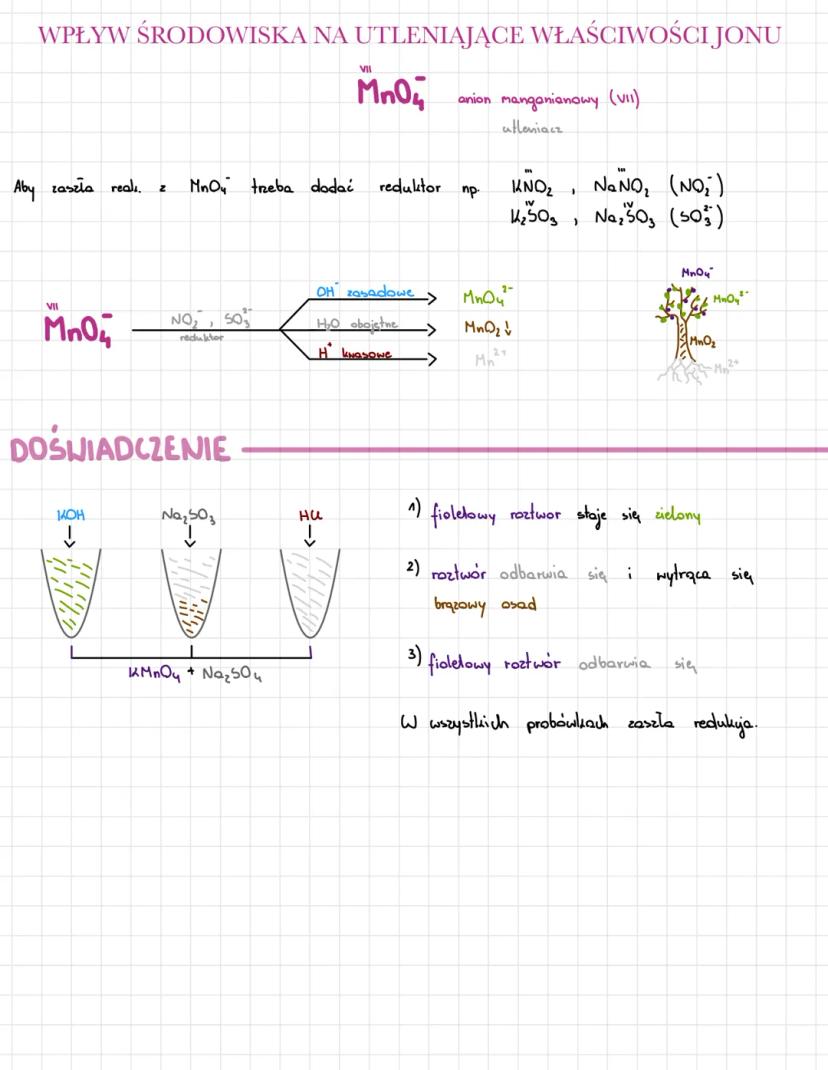
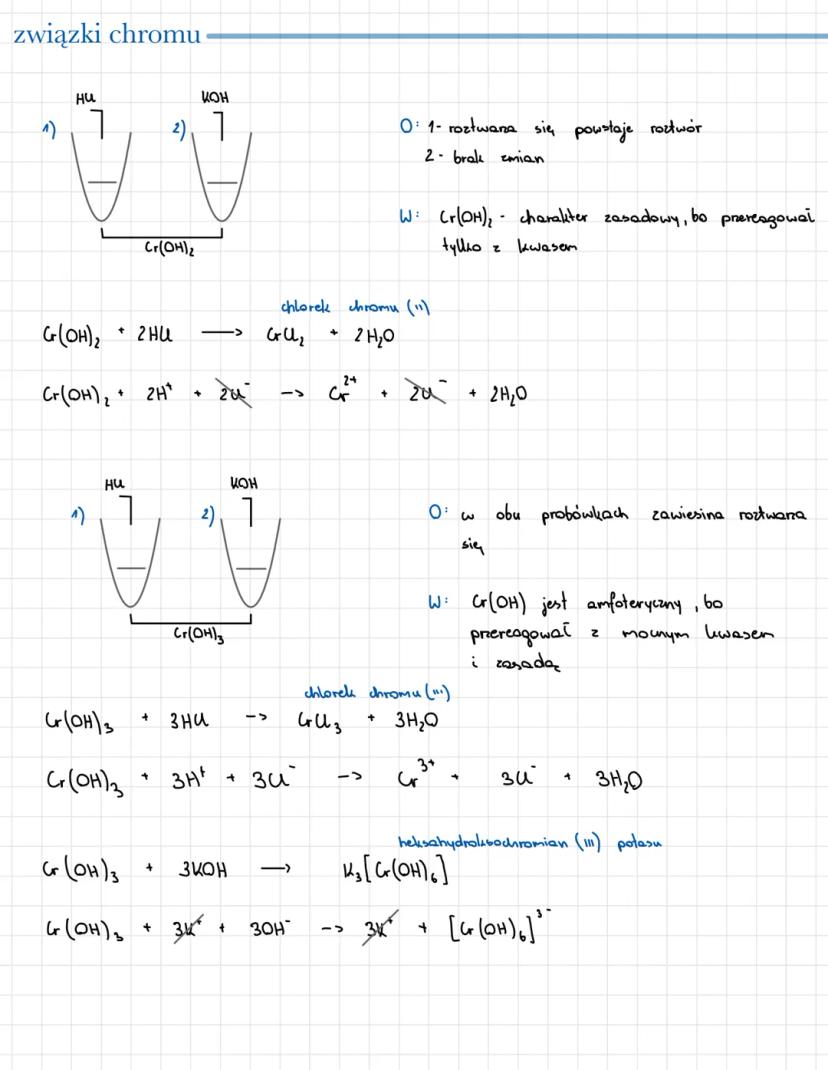
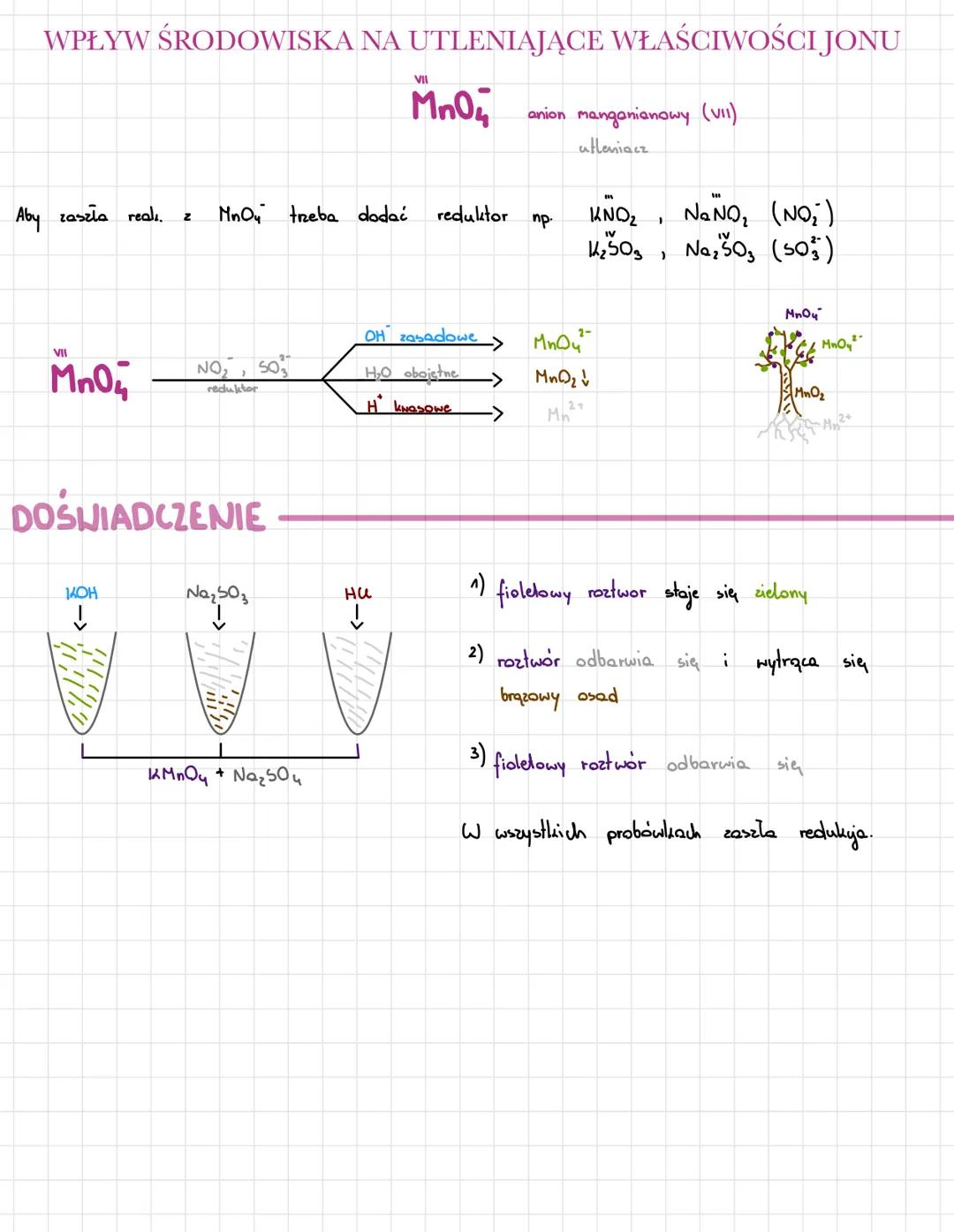
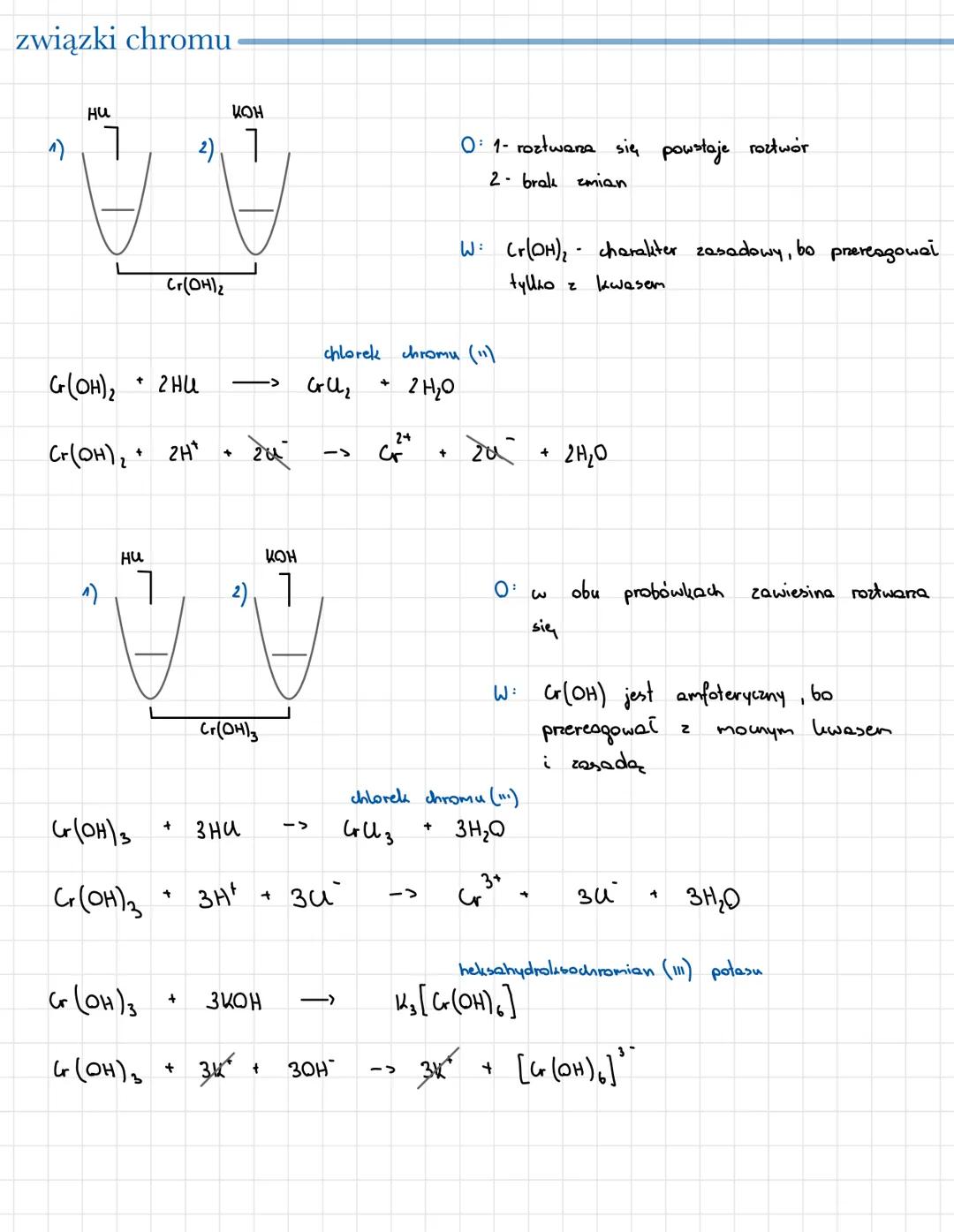
Mangan
Mangan (Mn) to metal o konfiguracji elektronowej [Ar] 4s² 3d⁵. Występuje głównie w stopniach utlenienia II, IV, VI i VII, co czyni go wszechstronnym pierwiastkiem w reakcjach chemicznych.
Jest dość aktywny chemicznie, ale na powietrzu ulega powolnej pasywacji. Reaguje z fluorowcami, siarką i kwasami nieutleniającymi, np. HCl, wypierając wodór:
Mn + 2HCl → MnCl₂ + H₂
Mangan to drugi po żelazie najbardziej rozpowszechniony metal przejściowy. Ma wysoką temperaturę topnienia, srebrzystą barwę z różowym połyskiem oraz jest twardy i kruchy. W przyrodzie występuje głównie jako braunsztyn (MnO₂), z którego otrzymuje się czysty mangan w procesie aluminotermii:
3MnO₂ + 4Al → 2Al₂O₃ + 3Mn
Ciekawostka! Mangan jest niezbędnym mikroelementem dla roślin i zwierząt - bierze udział w procesach enzymatycznych i wspiera prawidłowy rozwój organizmu.