Czas na poznanie chemii metali przejściowych! Chrom, mangan, żelazo i... Pokaż więcej
Zarejestruj się, aby zobaczyć notatkęTo nic nie kosztuje!
Dostęp do wszystkich materiałów
Popraw swoje oceny
Dołącz do milionów studentów
Rejestrując się akceptujesz Warunki korzystania z usługi i Politykę prywatności.






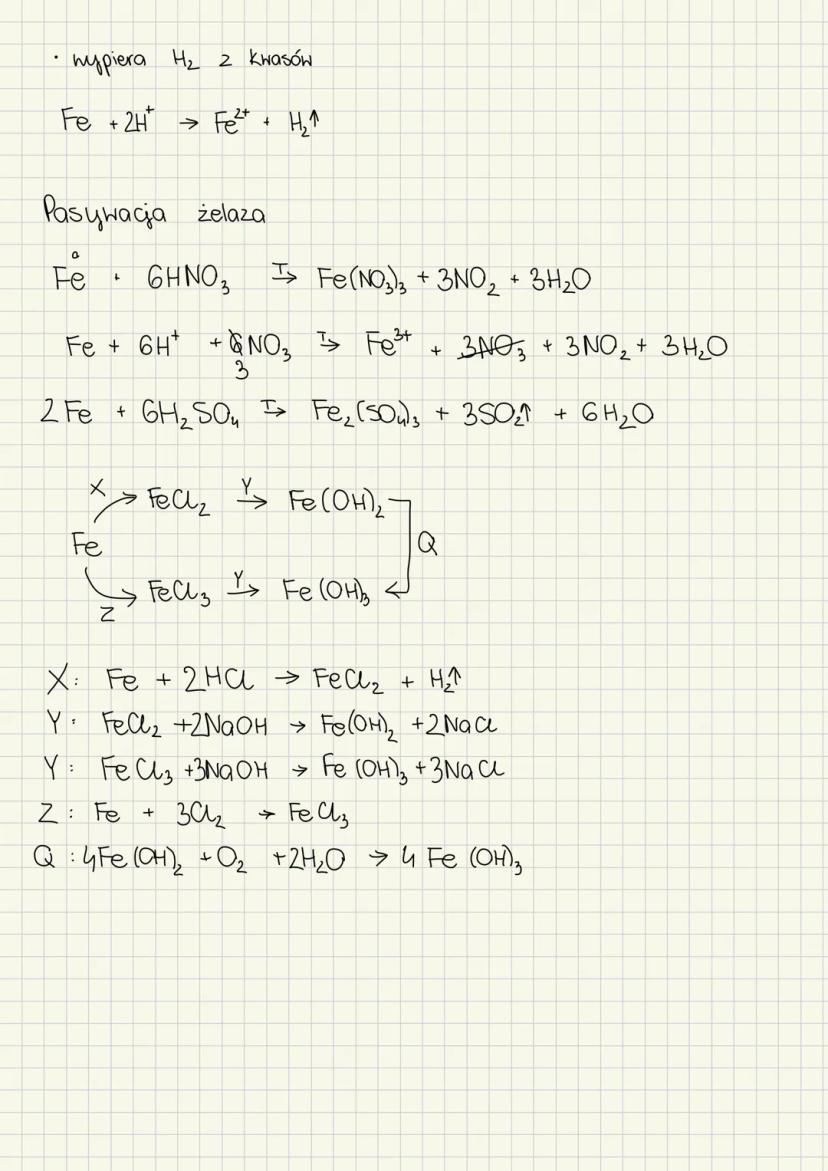


![# Cr
Cr [Ar] 4s¹ 3d⁵
- na powietnu ulega pasywacji
Henki i wodorotlenki chromu
CrO
Cr(OH)₂
H+
Cr²+
fon
chomu (11)
rasadony
Cr₂O₃](/_next/image?url=https%3A%2F%2Fcontent-eu-central-1.knowunity.com%2FCONTENT%2F01967da2-0e5c-7e4b-a279-c829b5ac5e9f_image_page_1.webp&w=2048&q=75)
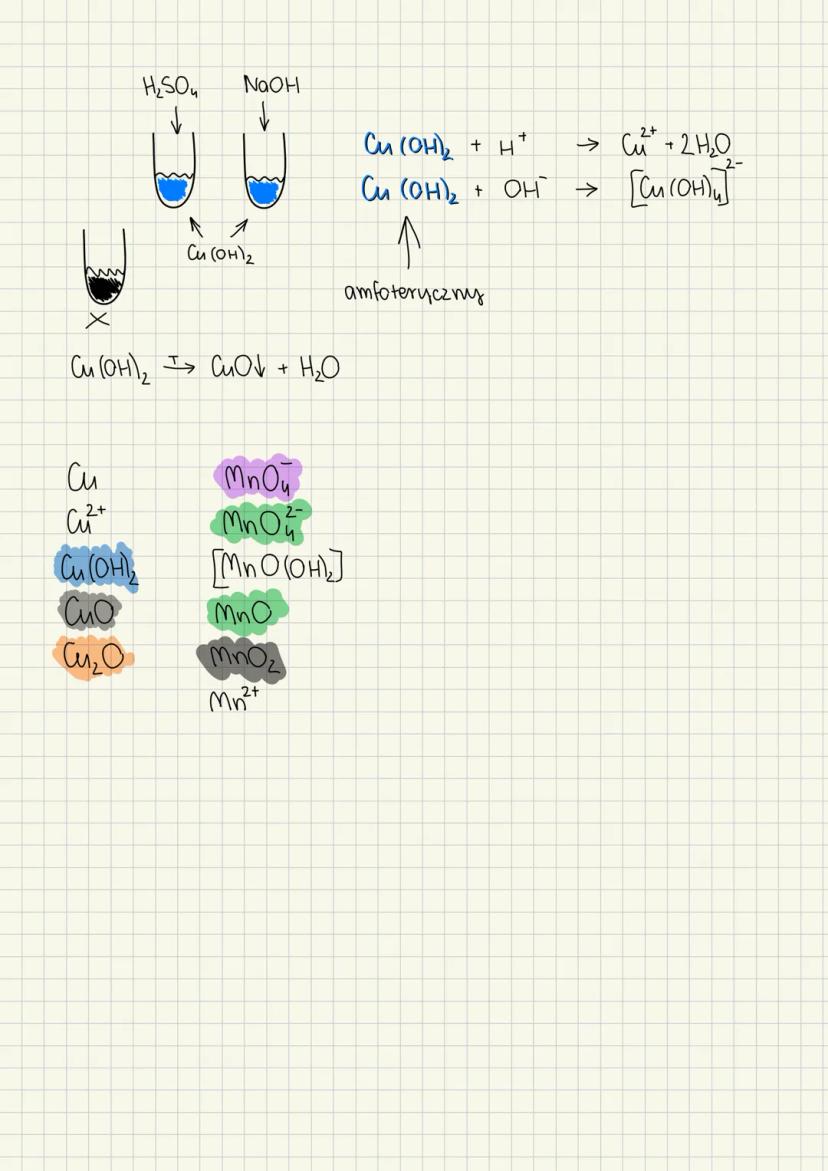
![# Cr
Cr [Ar] 4s¹ 3d⁵
- na powietnu ulega pasywacji
Henki i wodorotlenki chromu
CrO
Cr(OH)₂
H+
Cr²+
fon
chomu (11)
rasadony
Cr₂O₃](/_next/image?url=https%3A%2F%2Fcontent-eu-central-1.knowunity.com%2FCONTENT%2F01967da2-0e5c-7e4b-a279-c829b5ac5e9f_image_page_2.webp&w=2048&q=75)
![# Cr
Cr [Ar] 4s¹ 3d⁵
- na powietnu ulega pasywacji
Henki i wodorotlenki chromu
CrO
Cr(OH)₂
H+
Cr²+
fon
chomu (11)
rasadony
Cr₂O₃](/_next/image?url=https%3A%2F%2Fcontent-eu-central-1.knowunity.com%2FCONTENT%2F01967da2-0e5c-7e4b-a279-c829b5ac5e9f_image_page_3.webp&w=2048&q=75)
![# Cr
Cr [Ar] 4s¹ 3d⁵
- na powietnu ulega pasywacji
Henki i wodorotlenki chromu
CrO
Cr(OH)₂
H+
Cr²+
fon
chomu (11)
rasadony
Cr₂O₃](/_next/image?url=https%3A%2F%2Fcontent-eu-central-1.knowunity.com%2FCONTENT%2F01967da2-0e5c-7e4b-a279-c829b5ac5e9f_image_page_4.webp&w=2048&q=75)
![# Cr
Cr [Ar] 4s¹ 3d⁵
- na powietnu ulega pasywacji
Henki i wodorotlenki chromu
CrO
Cr(OH)₂
H+
Cr²+
fon
chomu (11)
rasadony
Cr₂O₃](/_next/image?url=https%3A%2F%2Fcontent-eu-central-1.knowunity.com%2FCONTENT%2F01967da2-0e5c-7e4b-a279-c829b5ac5e9f_image_page_5.webp&w=2048&q=75)
![# Cr
Cr [Ar] 4s¹ 3d⁵
- na powietnu ulega pasywacji
Henki i wodorotlenki chromu
CrO
Cr(OH)₂
H+
Cr²+
fon
chomu (11)
rasadony
Cr₂O₃](/_next/image?url=https%3A%2F%2Fcontent-eu-central-1.knowunity.com%2FCONTENT%2F01967da2-0e5c-7e4b-a279-c829b5ac5e9f_image_page_6.webp&w=2048&q=75)
![# Cr
Cr [Ar] 4s¹ 3d⁵
- na powietnu ulega pasywacji
Henki i wodorotlenki chromu
CrO
Cr(OH)₂
H+
Cr²+
fon
chomu (11)
rasadony
Cr₂O₃](/_next/image?url=https%3A%2F%2Fcontent-eu-central-1.knowunity.com%2FCONTENT%2F01967da2-0e5c-7e4b-a279-c829b5ac5e9f_image_page_7.webp&w=2048&q=75)
![# Cr
Cr [Ar] 4s¹ 3d⁵
- na powietnu ulega pasywacji
Henki i wodorotlenki chromu
CrO
Cr(OH)₂
H+
Cr²+
fon
chomu (11)
rasadony
Cr₂O₃](/_next/image?url=https%3A%2F%2Fcontent-eu-central-1.knowunity.com%2FCONTENT%2F01967da2-0e5c-7e4b-a279-c829b5ac5e9f_image_page_8.webp&w=2048&q=75)
![# Cr
Cr [Ar] 4s¹ 3d⁵
- na powietnu ulega pasywacji
Henki i wodorotlenki chromu
CrO
Cr(OH)₂
H+
Cr²+
fon
chomu (11)
rasadony
Cr₂O₃](/_next/image?url=https%3A%2F%2Fcontent-eu-central-1.knowunity.com%2FCONTENT%2F01967da2-0e5c-7e4b-a279-c829b5ac5e9f_image_page_9.webp&w=2048&q=75)
![# Cr
Cr [Ar] 4s¹ 3d⁵
- na powietnu ulega pasywacji
Henki i wodorotlenki chromu
CrO
Cr(OH)₂
H+
Cr²+
fon
chomu (11)
rasadony
Cr₂O₃](/_next/image?url=https%3A%2F%2Fcontent-eu-central-1.knowunity.com%2FCONTENT%2F01967da2-0e5c-7e4b-a279-c829b5ac5e9f_image_page_10.webp&w=2048&q=75)