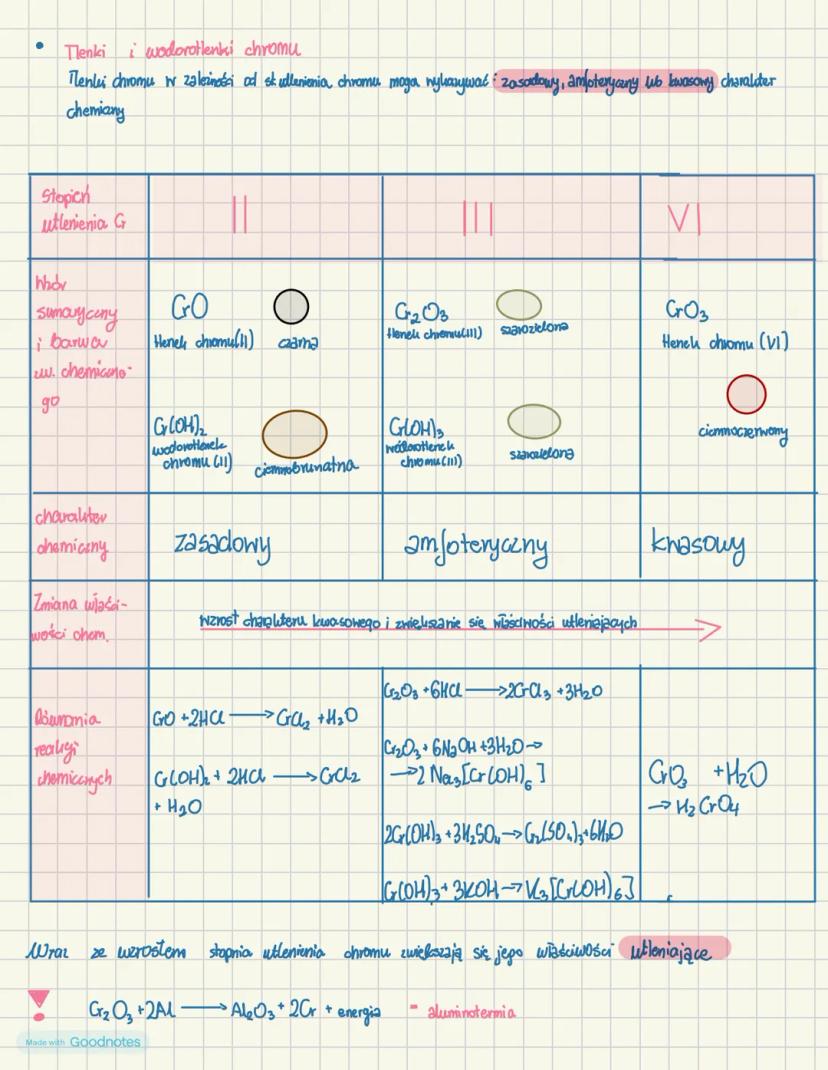
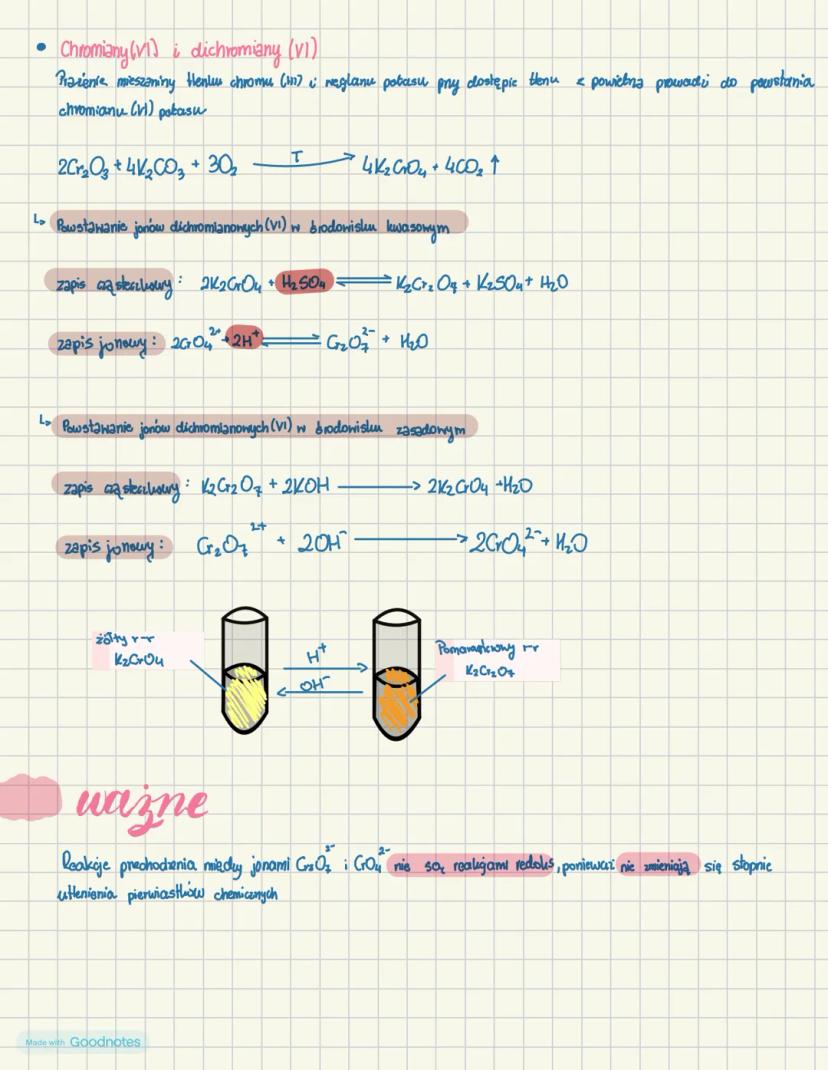
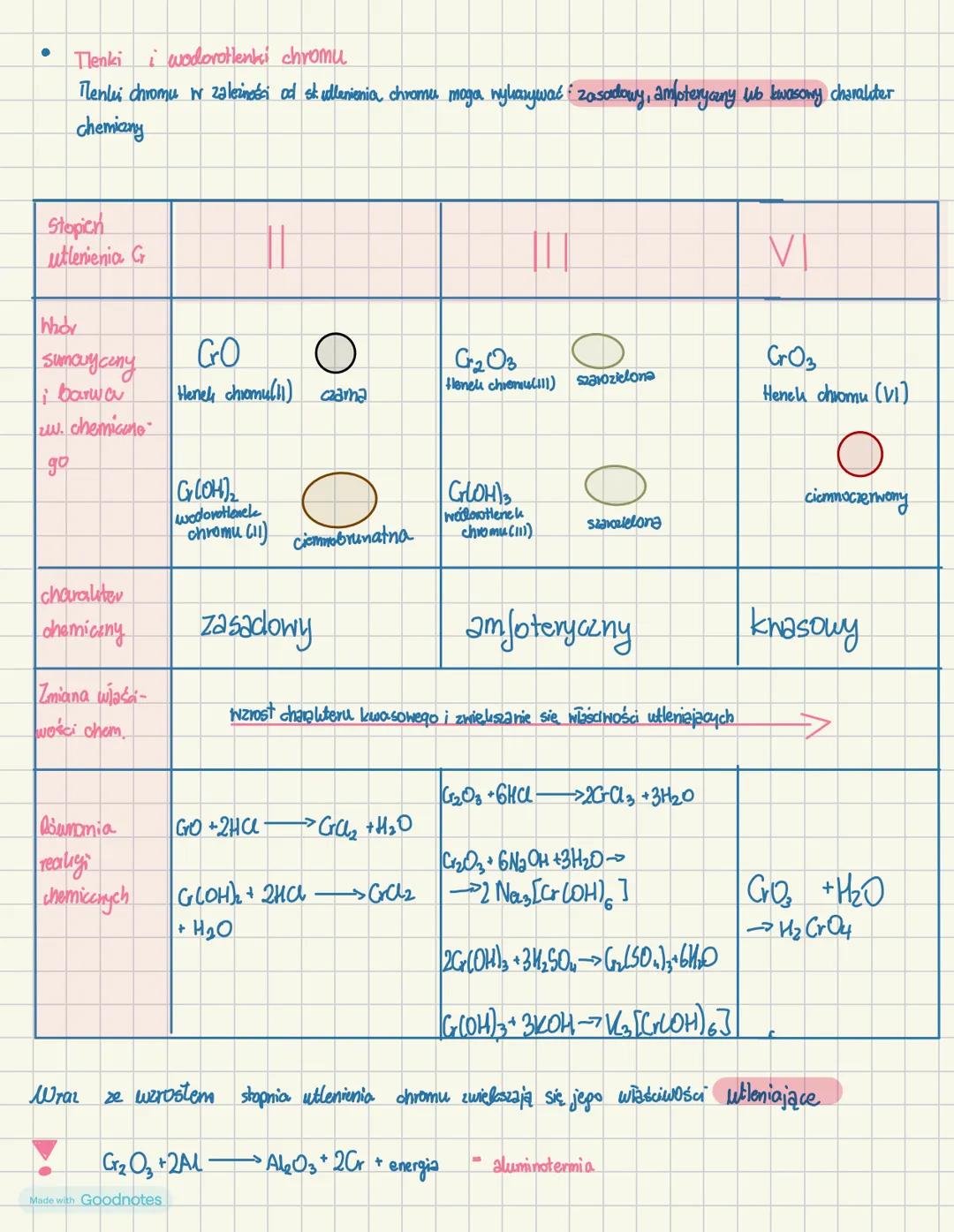
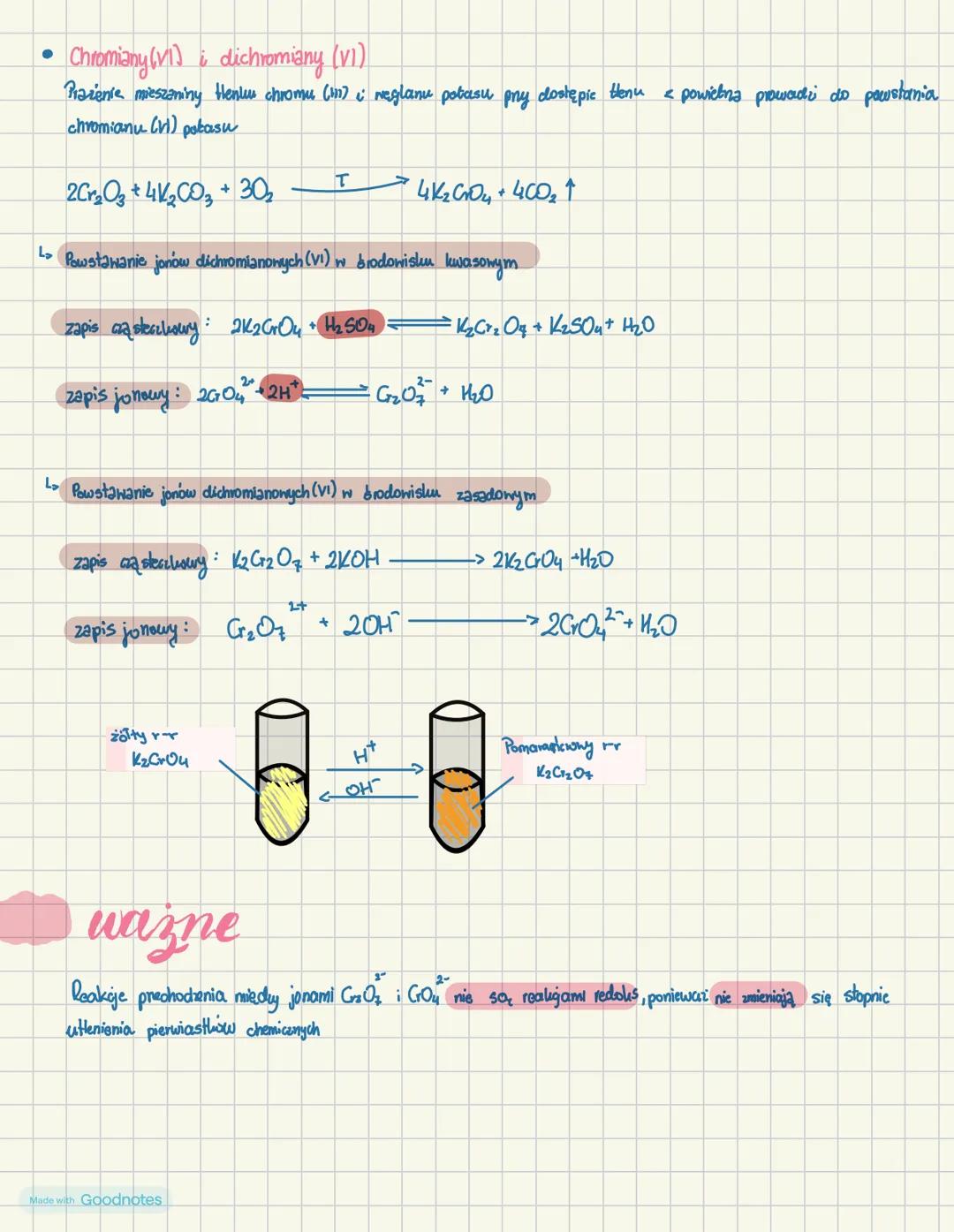
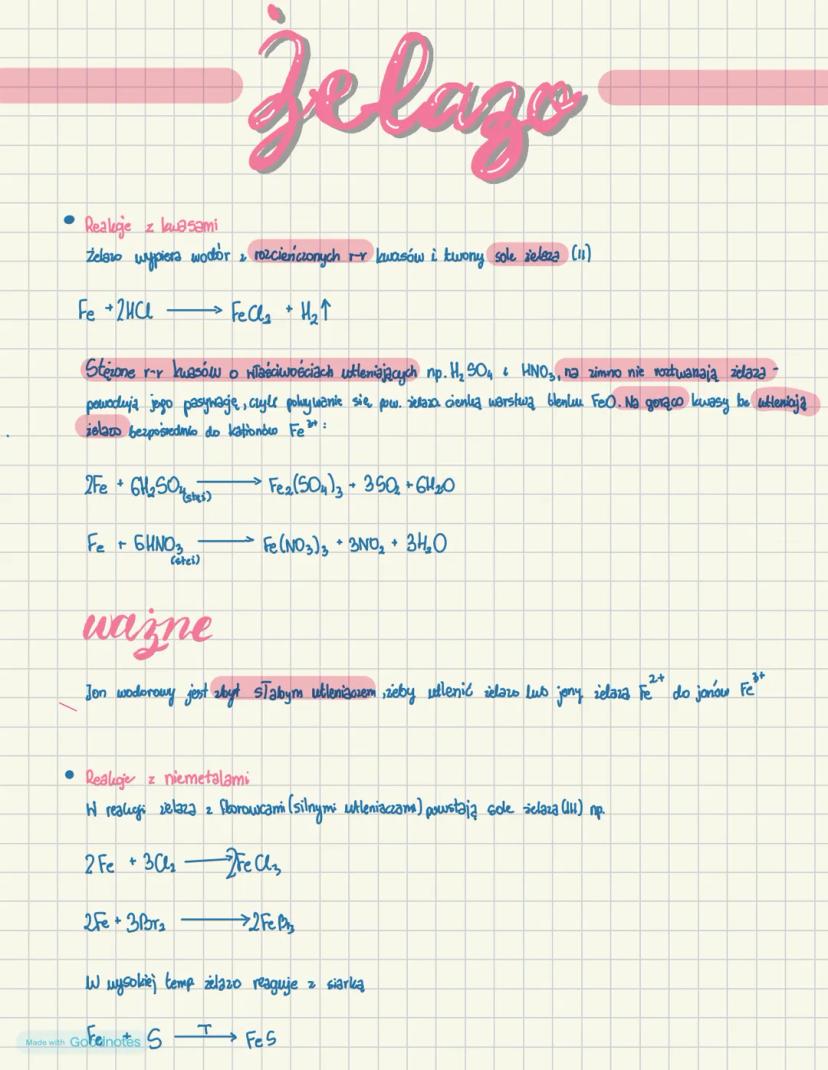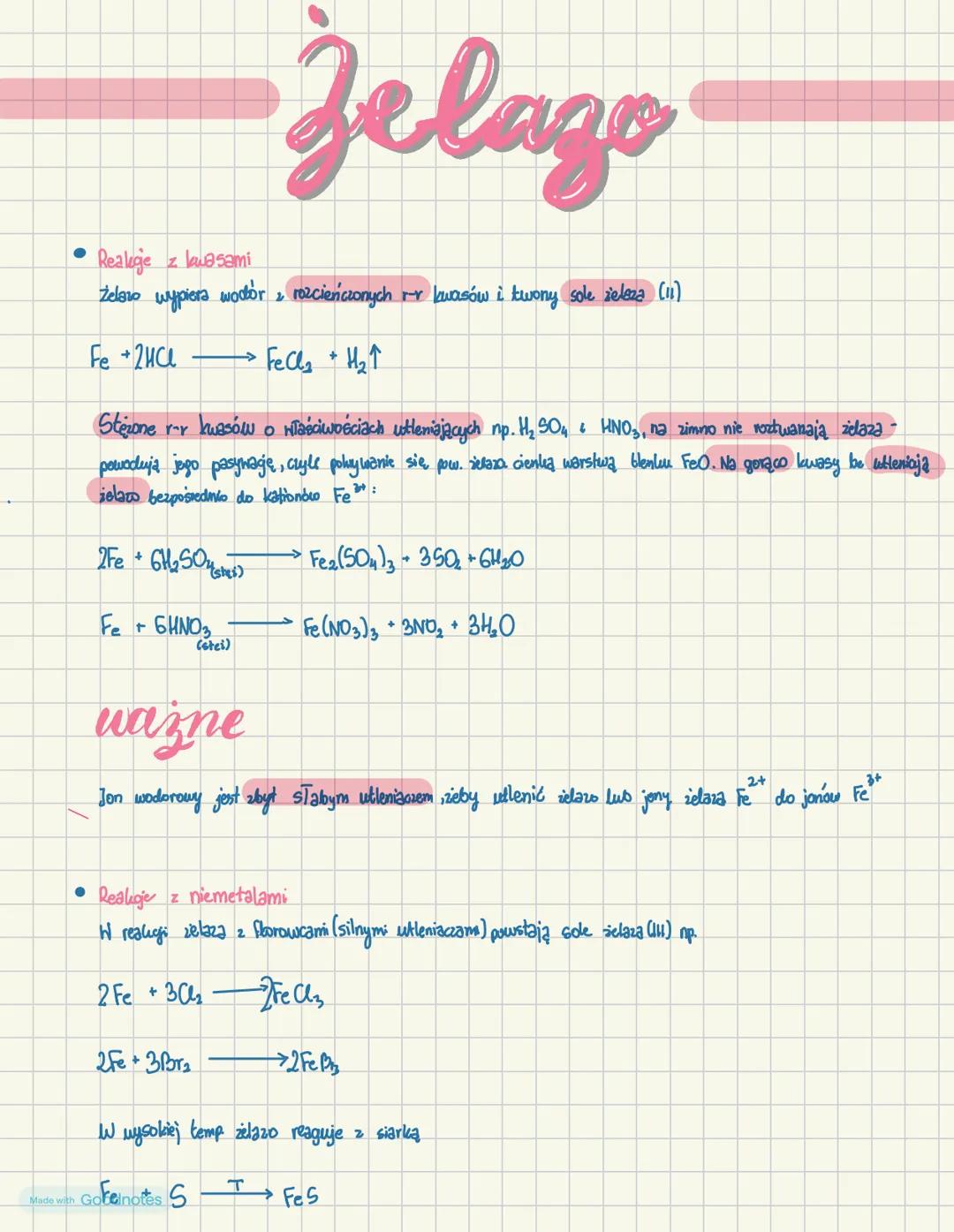Cynk - metal o właściwościach amfoterycznych
Cynk jest metalem o właściwościach amfoterycznych, co oznacza, że reaguje zarówno z kwasami, jak i z zasadami.
W reakcji z kwasami nieutleniającymi cynk rozpuszcza się, tworząc sole cynku i uwalniając wodór:
Zn + 2HCl → ZnCl₂ + H₂↑
Cynk rozpuszcza się również w gorących roztworach mocnych zasad, tworząc tetrahydroksocynkany:
Zn + 2OH⁻ + 2H₂O → [Zn(OH)₄]²⁻ + H₂↑
Na powietrzu cynk pokrywa się cienką warstwą tlenku cynku, co powoduje, że jego powierzchnia traci połysk:
2Zn + O₂ → 2ZnO
Wodorotlenek cynku można otrzymać w reakcji strącania:
Zn²⁺ + 2OH⁻ → Zn(OH)₂↓
Kluczowa właściwość: Wodorotlenek cynku jest trudno rozpuszczalny w wodzie i wykazuje charakter amfoteryczny - reaguje zarówno z kwasami, jak i z zasadami, tworząc rozpuszczalne kompleksy.