Dysocjacja słabej zasady i moc elektrolitów
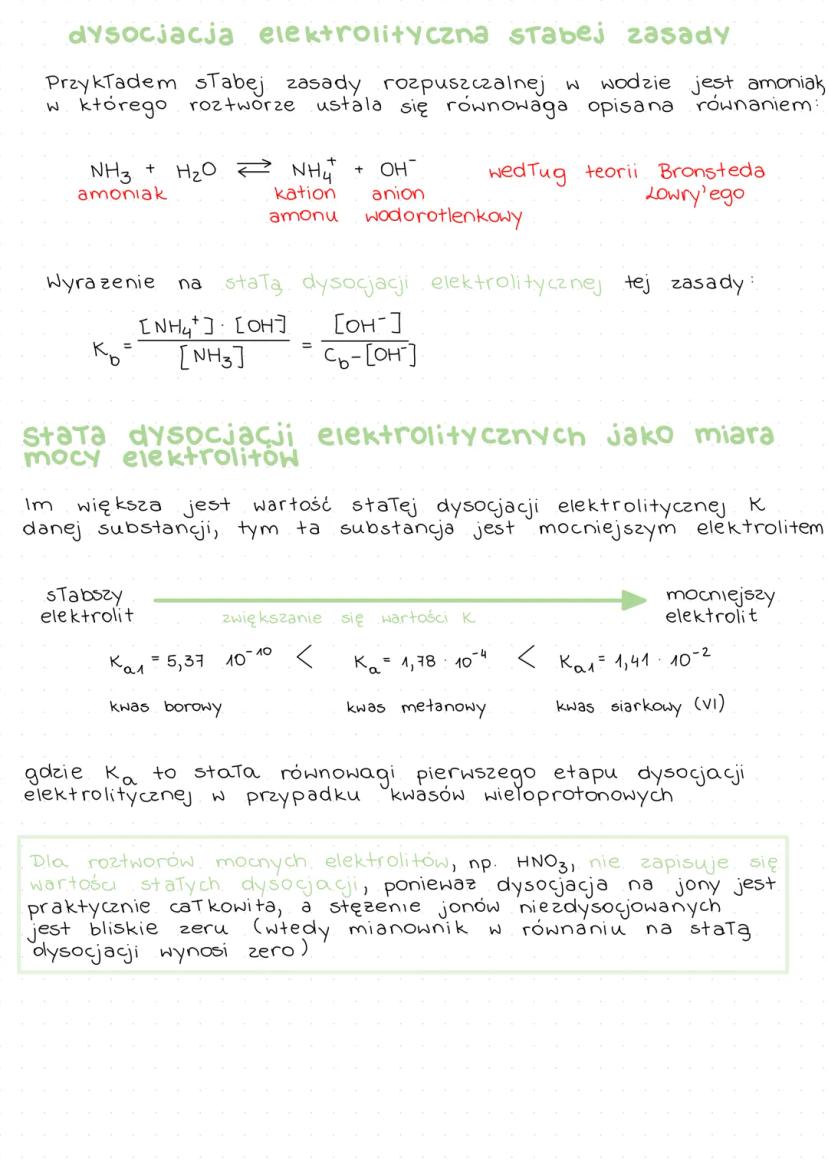
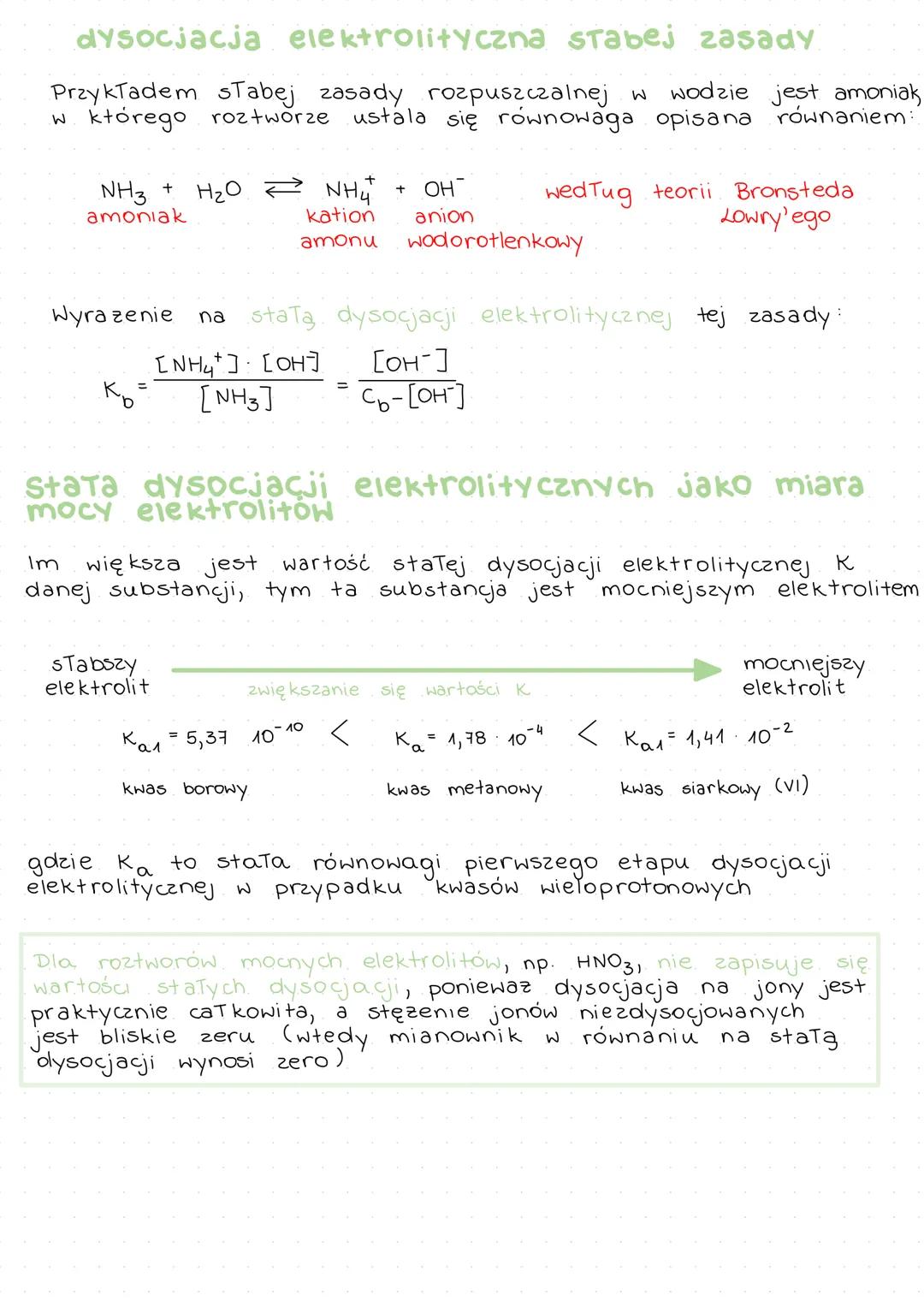
Amoniak (NH₃) jest przykładem słabej zasady rozpuszczalnej w wodzie. W jego roztworze ustala się równowaga:
NH₃ + H₂O ⇄ NH₄⁺ + OH⁻
Stałą dysocjacji tej zasady wyrażamy wzorem:
Kᵦ = ([NH₄⁺]·[OH⁻])/[NH₃] = [OH⁻]/Cβ−[OH−]
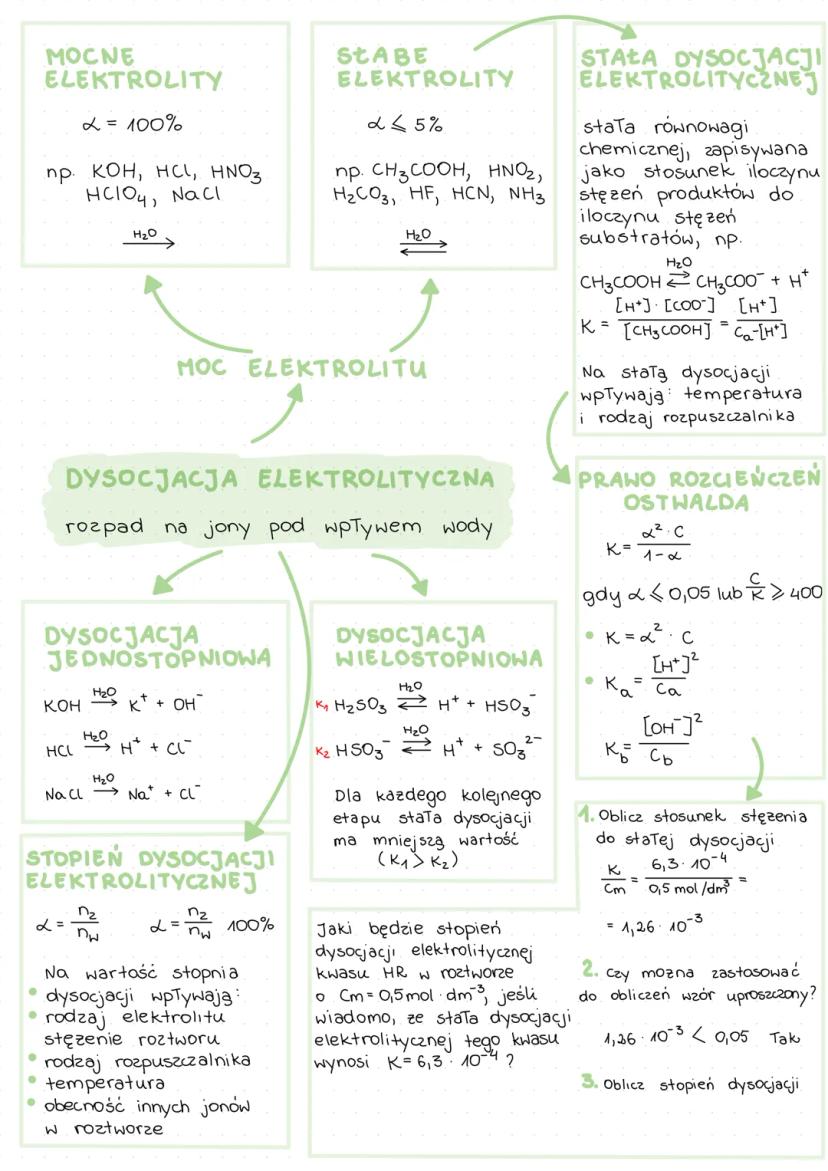
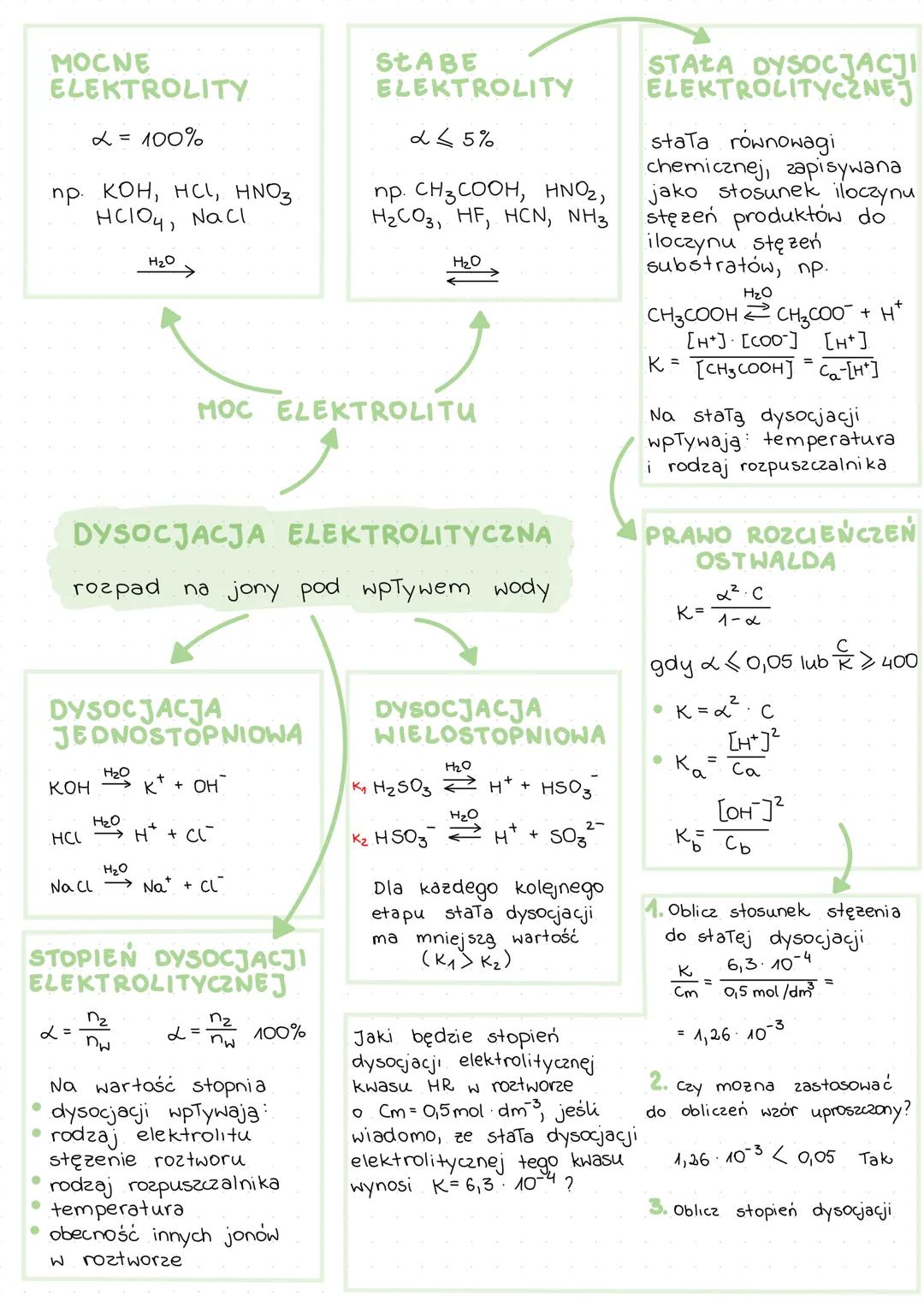
Wartość stałej dysocjacji elektrolitycznej K jest miarą mocy elektrolitu - im większa wartość K, tym substancja jest mocniejszym elektrolitem. Na przykład:
Kₐ₁ = 5,37·10⁻¹⁰ (kwas borowy) < Kₐ₁ = 1,78·10⁻⁴ (kwas metanowy) < Kₐ₁ = 1,41·10⁻² (kwas siarkowy(VI))
Dla mocnych elektrolitów, takich jak HNO₃, nie podaje się wartości stałych dysocjacji, ponieważ dysocjacja jest praktycznie całkowita, a stężenie cząsteczek niezdysocjowanych jest bliskie zeru.
⭐ Zapamiętaj: Im większa wartość K, tym mocniejszy elektrolit, niezależnie od jego stężenia!