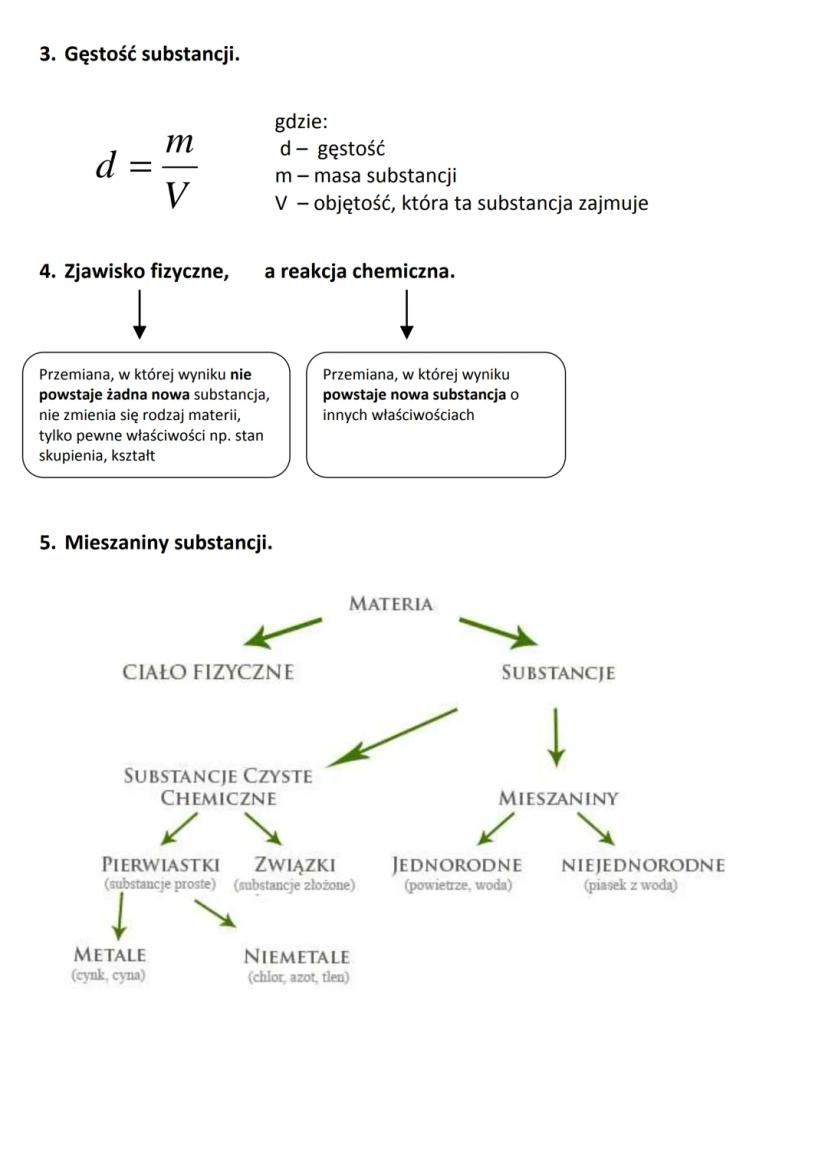
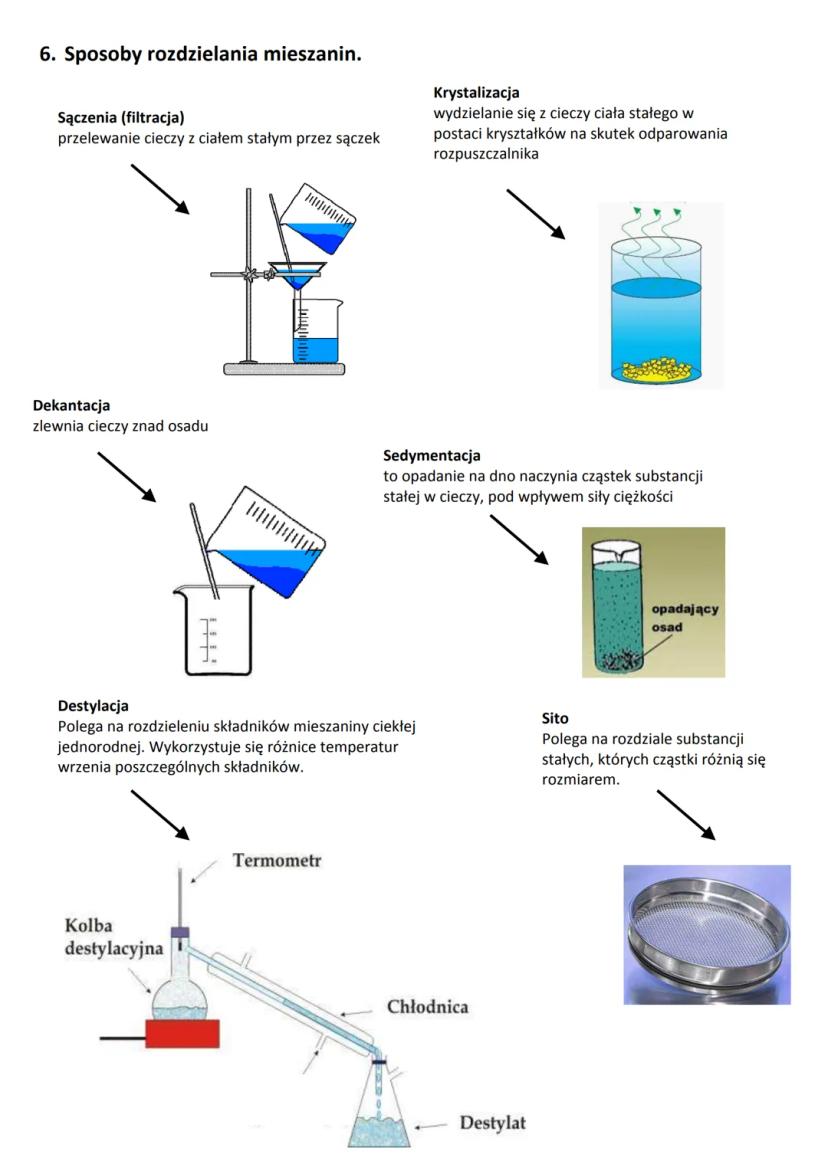
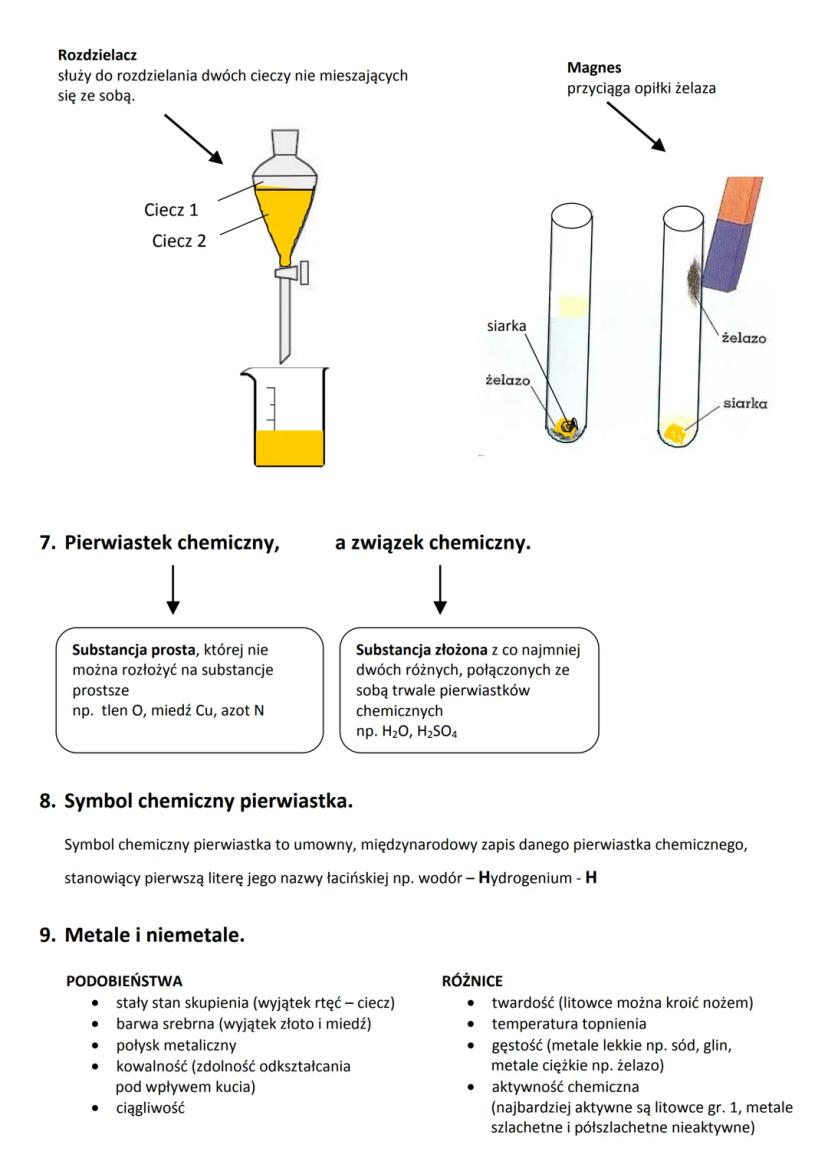
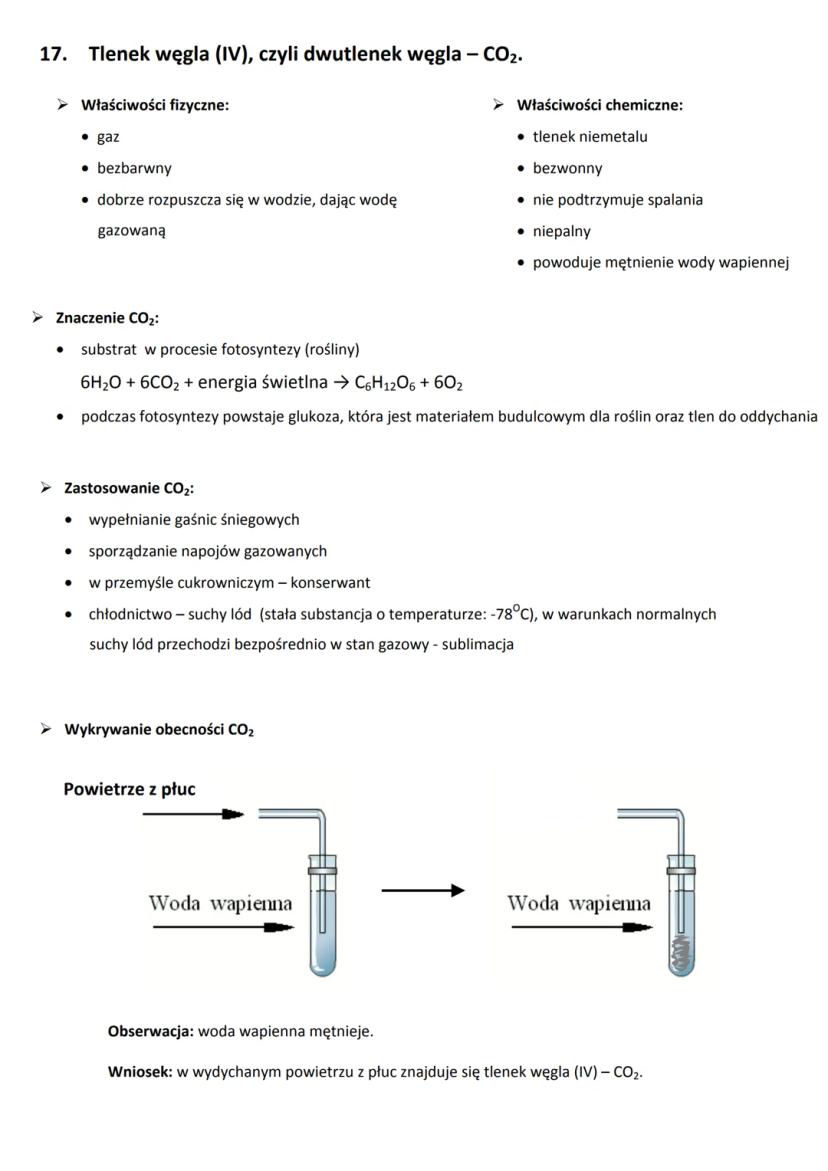
Azot i gazy szlachetne
Azot (N₂) to najważniejszy składnik powietrza (78%). Jest gazem bezbarwnym i bezwonnym, który słabo rozpuszcza się w wodzie. W przeciwieństwie do tlenu, azot nie podtrzymuje spalania i jest niepalny. To właśnie dzięki obecności azotu w powietrzu procesy spalania nie przebiegają zbyt gwałtownie.
Azot jest niezbędny dla prawidłowego rozwoju roślin. Wykorzystuje się go do produkcji:
- amoniaku
- nawozów sztucznych
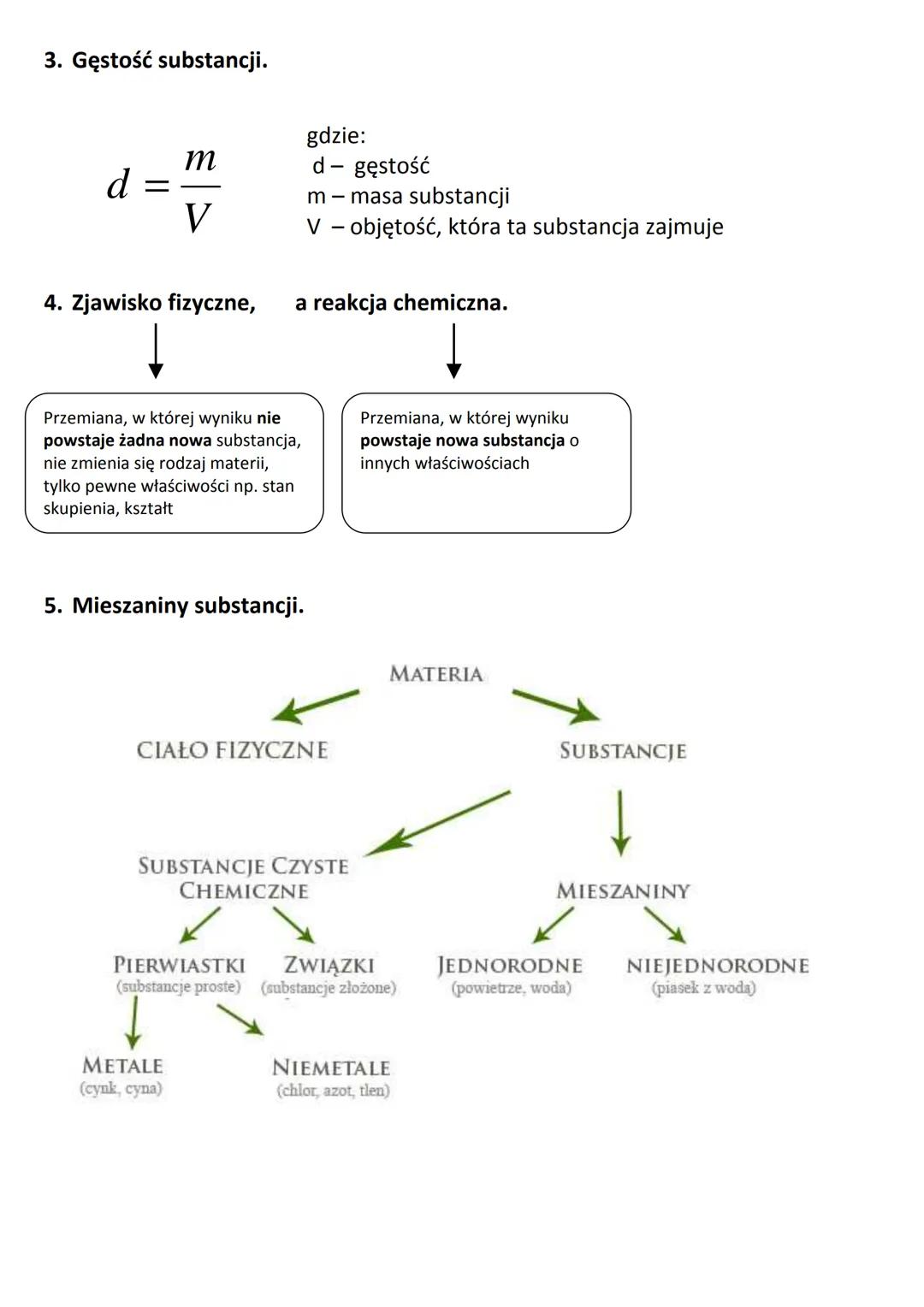
- materiałów wybuchowych
Ciekły azot o temperaturze -196°C stosuje się do szybkiego zamrażania produktów spożywczych i w medycynie.
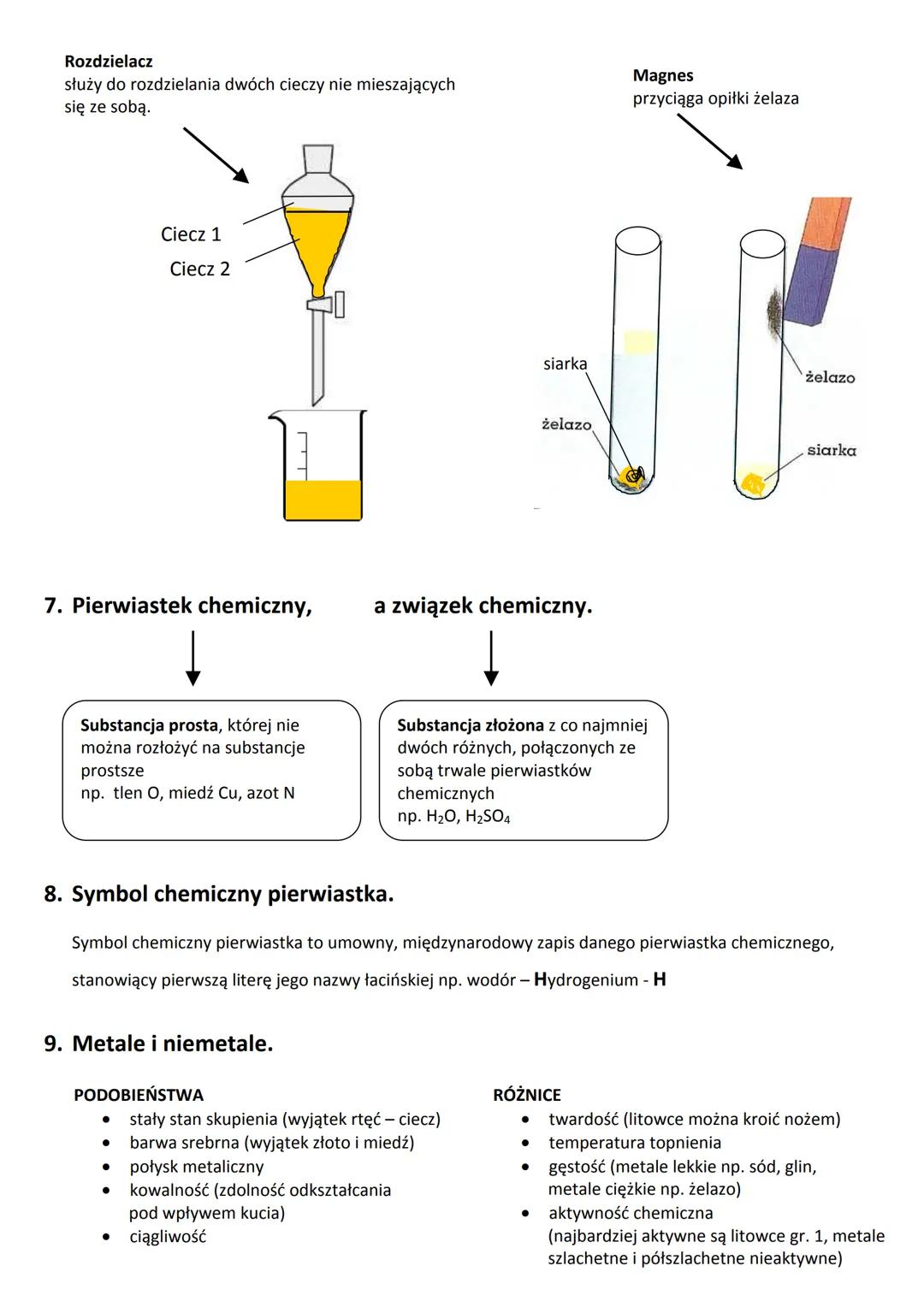
Gazy szlachetne (grupa 18 układu okresowego) to wyjątkowe pierwiastki, które występują w powietrzu w niewielkiej ilości (około 1%). Są to: hel, neon, argon, krypton, ksenon i radon. Ich nazwa pochodzi stąd, że są bardzo mało reaktywne - mają zapełnioną powłokę walencyjną (8 elektronów).
Gazy szlachetne są bezbarwne i bezwonne. Pobudzone polem elektrycznym pięknie świecą, dlatego stosuje się je w technice oświetleniowej (np. neony). Hel wykorzystuje się w medycynie, balonach i sondach meteorologicznych.
🎈 Eksperyment: Gdy wdychamy hel, nasz głos staje się bardzo wysoki. Dzieje się tak dlatego, że hel ma mniejszą gęstość niż powietrze i fale dźwiękowe rozchodzą się w nim szybciej.