Obliczenia dla jonów i wiązania chemiczne
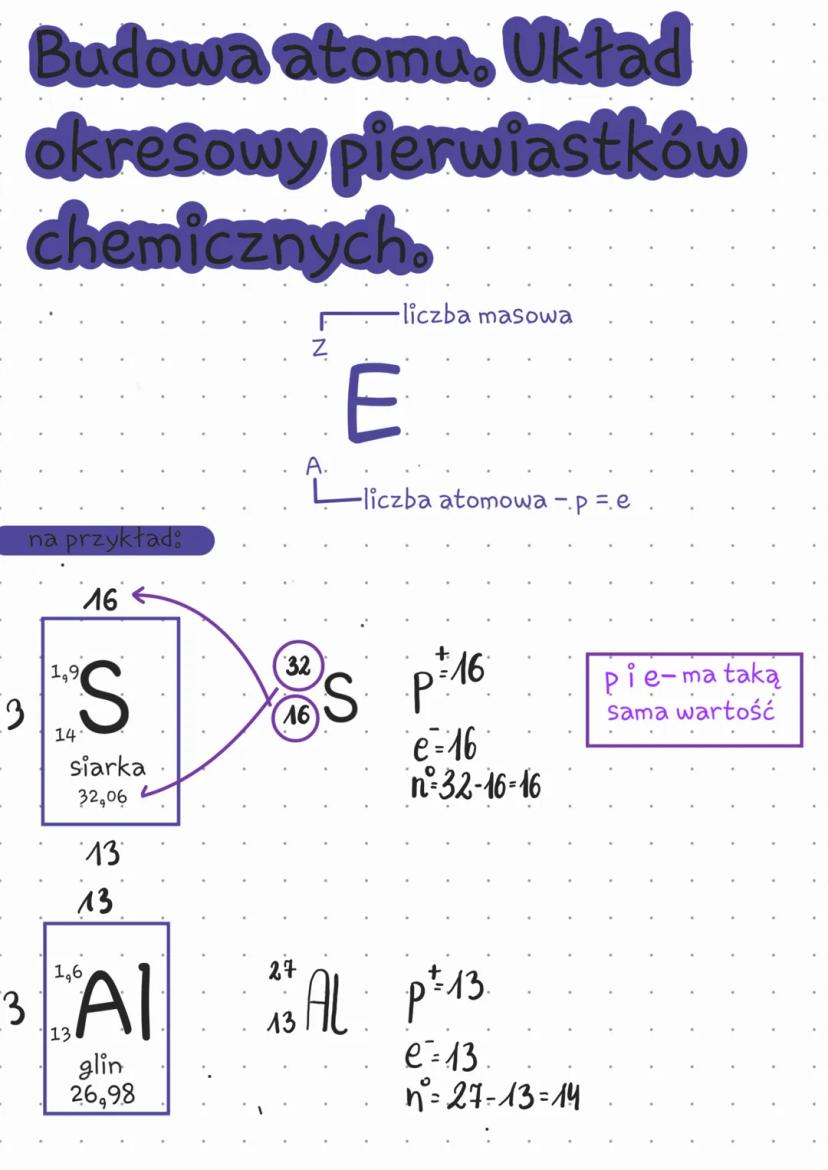
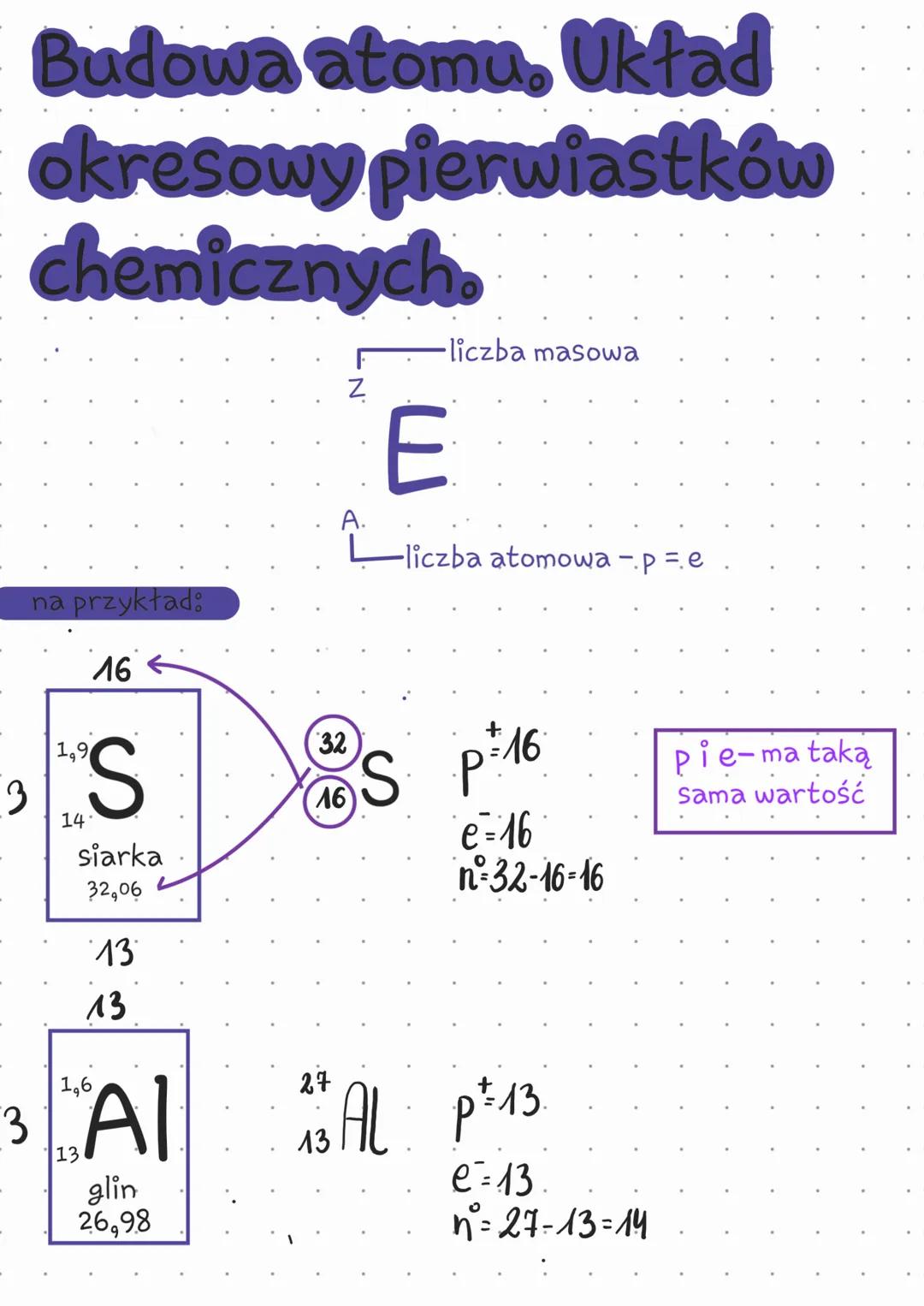
W jonie tlenkowym O²⁻ liczba protonów wynosi 8 (liczba atomowa tlenu), liczba elektronów to 8+2=10 (atom przyjął 2 elektrony), a liczba neutronów to 16-8=8, zakładając liczbę masową 16.
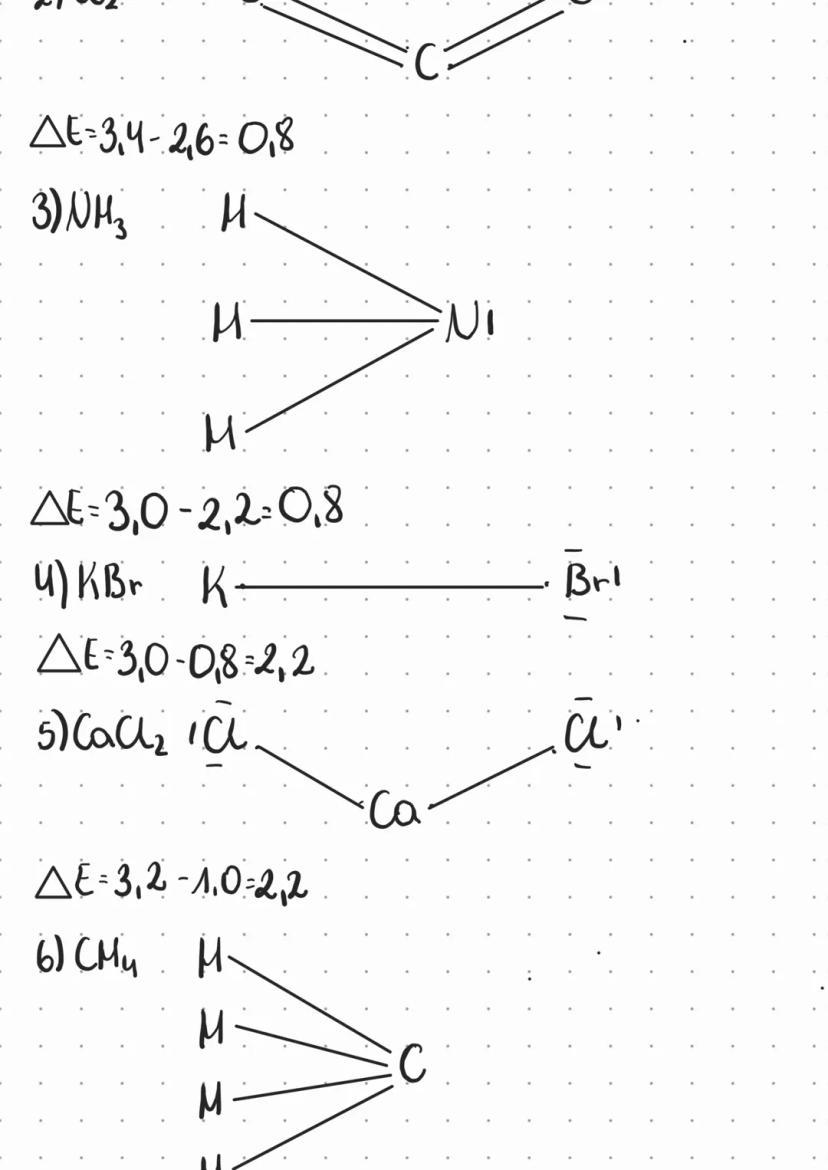
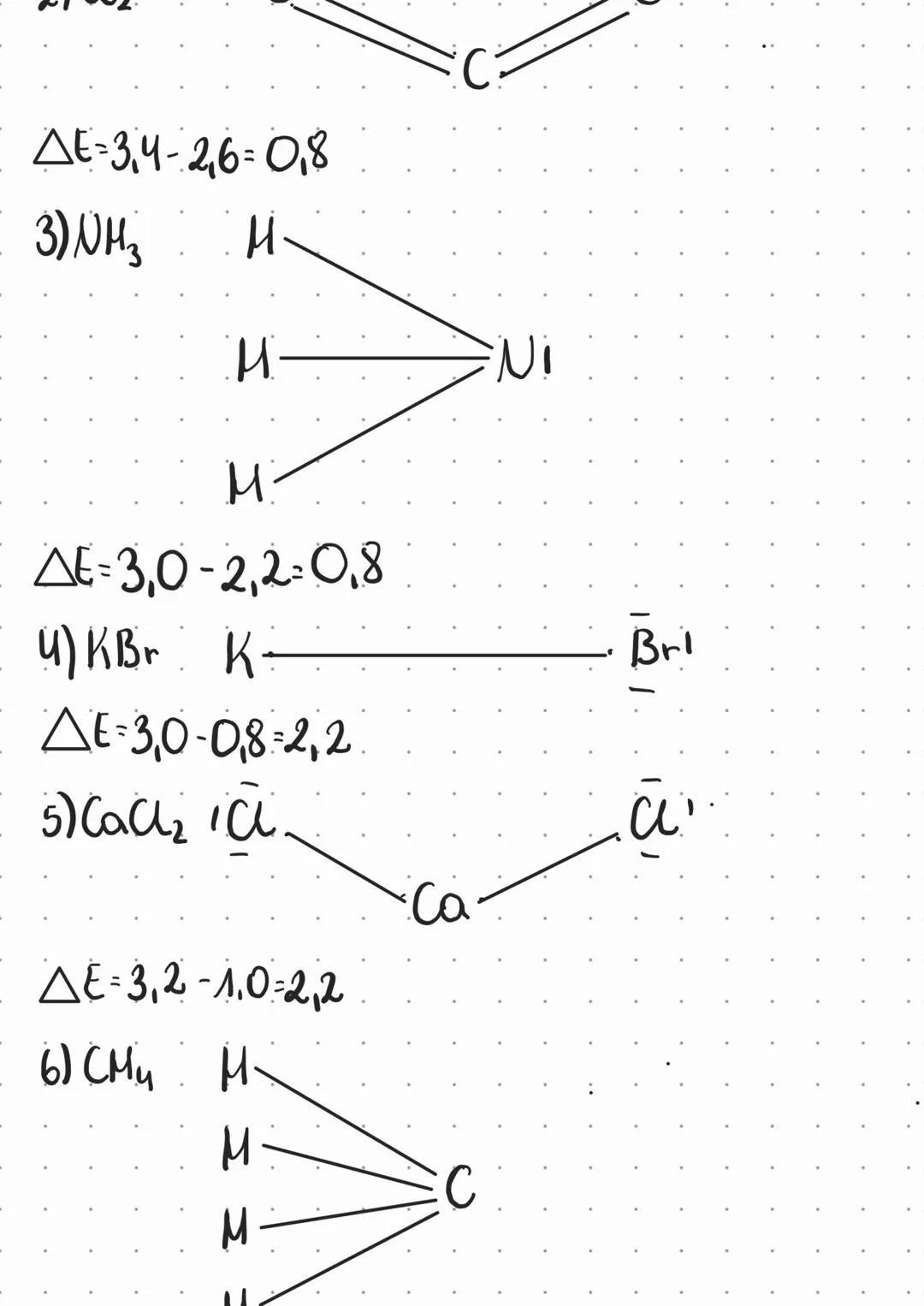
Rodzaj wiązania chemicznego zależy od różnicy elektroujemności (ΔE) między pierwiastkami. Dla przykładu, w związku LiF różnica wynosi ΔE=3,4-1,0=2,4, co wskazuje na wiązanie jonowe (ΔE>1,7).
W przypadku związków jak CH₄, NH₃, czy MgH₂, różnica elektroujemności jest mniejsza, wskazując na wiązanie kowalencyjne spolaryzowane (0,4<ΔE<1,7) lub niespolaryzowane (ΔE<0,4).
Zapamiętaj wzór! Im większa różnica elektroujemności między pierwiastkami, tym wiązanie ma bardziej jonowy charakter. Przyjmujemy, że przy ΔE>1,7 wiązanie jest jonowe.