Kwaśne opady i skala pH
Kwaśne opady to jedno z poważniejszych zagrożeń dla środowiska. Powstają, gdy zanieczyszczenia powietrza w postaci tlenków niemetali (głównie SO₂ i NOₓ) reagują z wodą w atmosferze, tworząc roztwory kwasów.
Kwaśne deszcze, śniegi i mgły mają niszczący wpływ na przyrodę i infrastrukturę. Powodują korozję budynków i zabytków, zakwaszają gleby i zbiorniki wodne, prowadząc do wymierania roślin i zwierząt. W zakwaszonej glebie rośliny mają problemy z fotosyntezą i pobieraniem składników odżywczych.
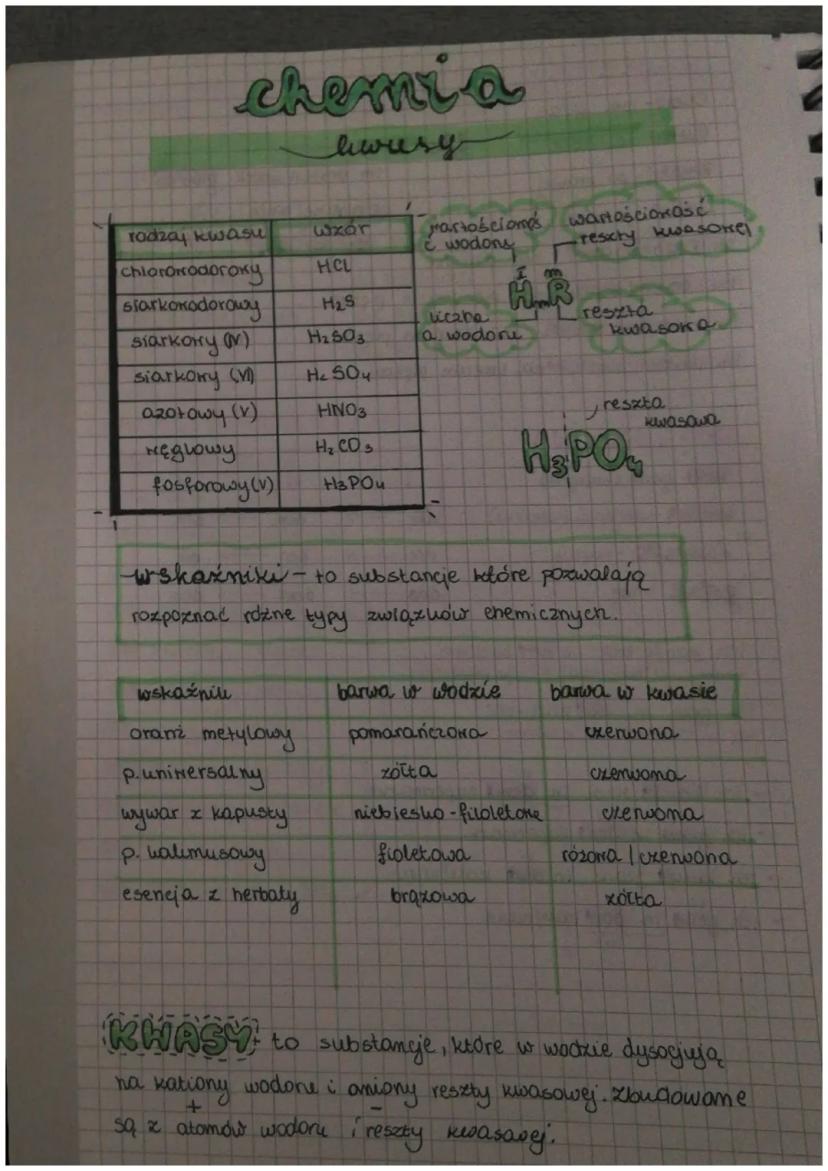
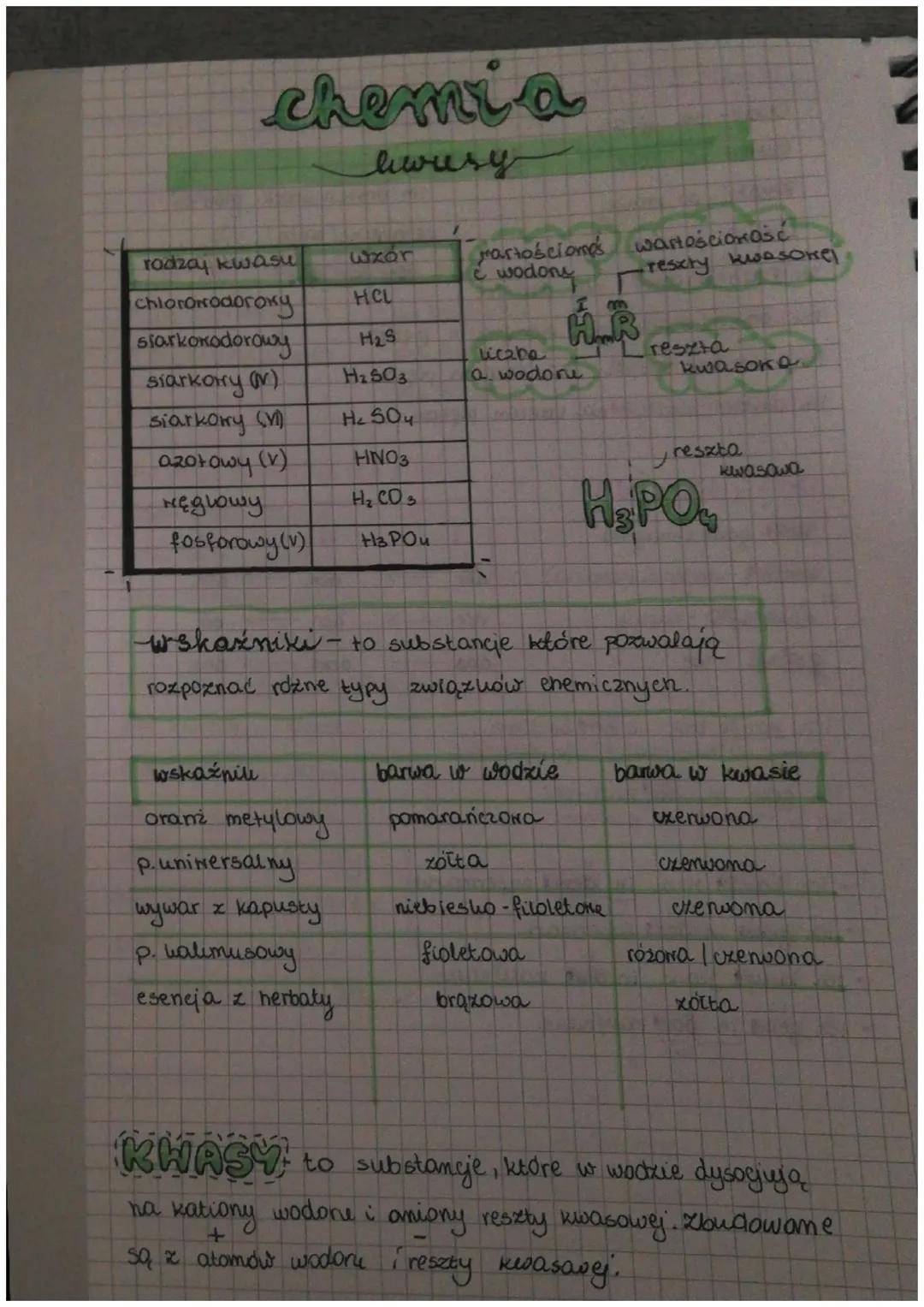
Do określania kwasowości roztworów używamy skali pH, która przyjmuje wartości od 1 do 14. Roztwory o pH poniżej 7 mają odczyn kwaśny (więcej jonów H⁺ niż OH⁻), pH równe 7 oznacza odczyn obojętny (równowaga jonów H⁺ i OH⁻), a pH powyżej 7 wskazuje na odczyn zasadowy (więcej jonów OH⁻ niż H⁺).
Do otrzymywania kwasów stosujemy dwie metody: dla kwasów beztlenowych - reakcja wodoru z niemetalem, a dla kwasów tlenowych - reakcja tlenku niemetalu z wodą.
🌧️ Pamiętaj: Naturalne opady deszczu mają pH około 5,6 (lekko kwaśne) ze względu na rozpuszczony CO₂, ale kwaśne deszcze mogą mieć pH nawet poniżej 4, co jest szkodliwe dla środowiska!