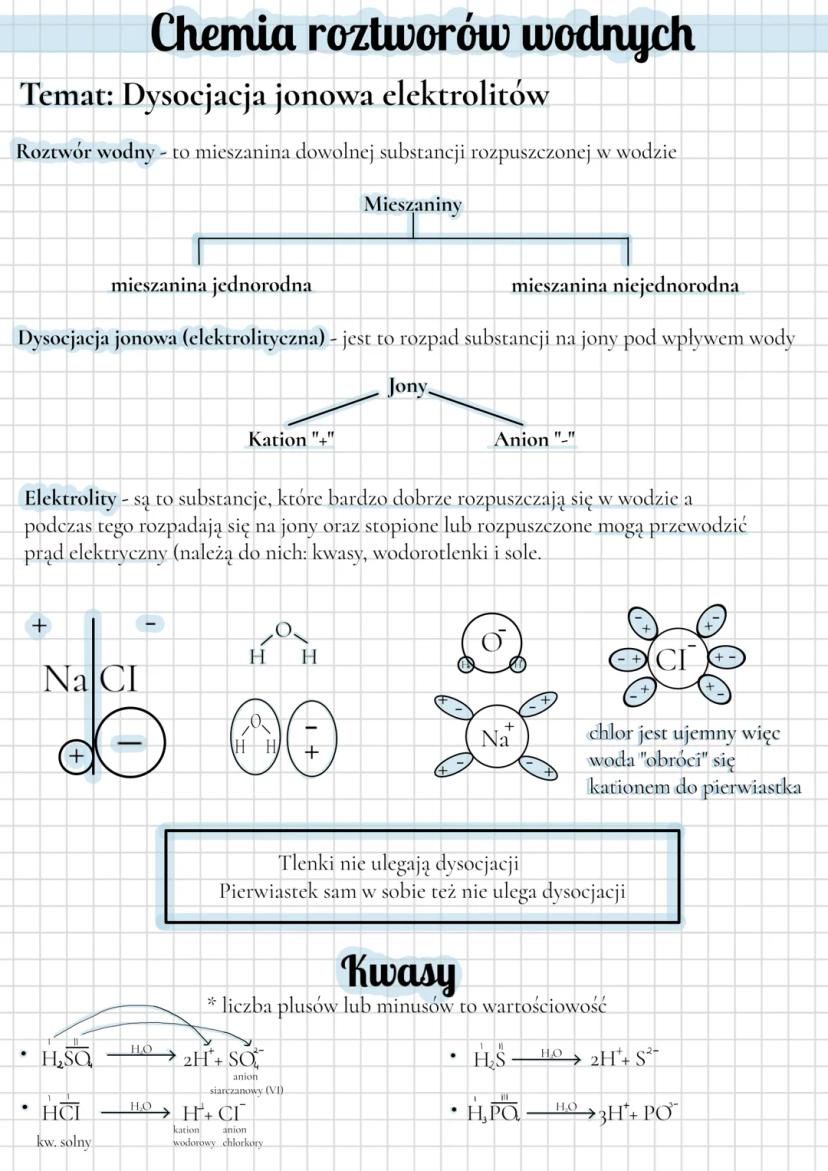
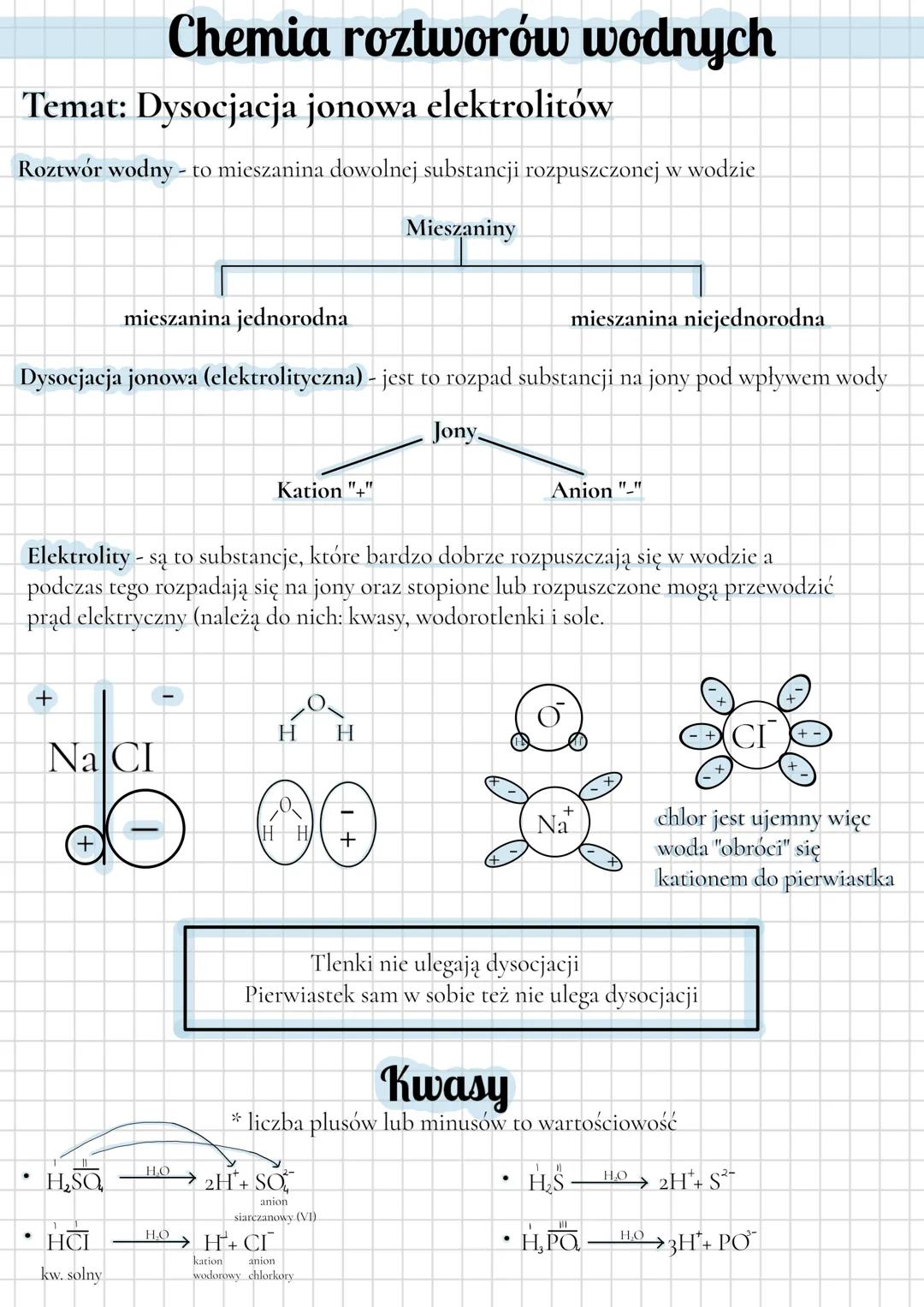
pH i reakcje jonowe
Przy obliczaniu pH roztworów wodorotlenków metali pamiętaj, że wodorotlenek rozpadając się daje tyle jonów OH⁻, ile grup wodorotlenkowych zawiera:
Przykład: Dla roztworu Ca(OH)₂ o stężeniu 0,00005 mol/dm³:
- [OH⁻] = 2 × 0,00005 = 0,0001 mol/dm³
- pOH = -log(0,0001) = 4
- pH = 14 - 4 = 10
Jedną z najważniejszych reakcji jonowych jest reakcja zobojętniania, w której kwas reaguje z zasadą, tworząc sól i wodę:
Kwas + Zasada → Sól + Woda
Odczyn roztworu po reakcji zależy od ilości reagentów:
- Jeśli ilości są równoważne, otrzymujemy roztwór obojętny (pH ≈ 7)
- Nadmiar kwasu daje odczyn kwasowy (pH < 7)
- Nadmiar zasady daje odczyn zasadowy (pH > 7)
W zapisie jonowym reakcji zobojętniania kluczowa jest reakcja:
H⁺ + OH⁻ → H₂O
Praktyczne zastosowanie: Reakcje zobojętniania są podstawą działania leków na zgagę, które neutralizują nadmiar kwasu w żołądku, oraz regulatorów pH w basenach czy akwariach.