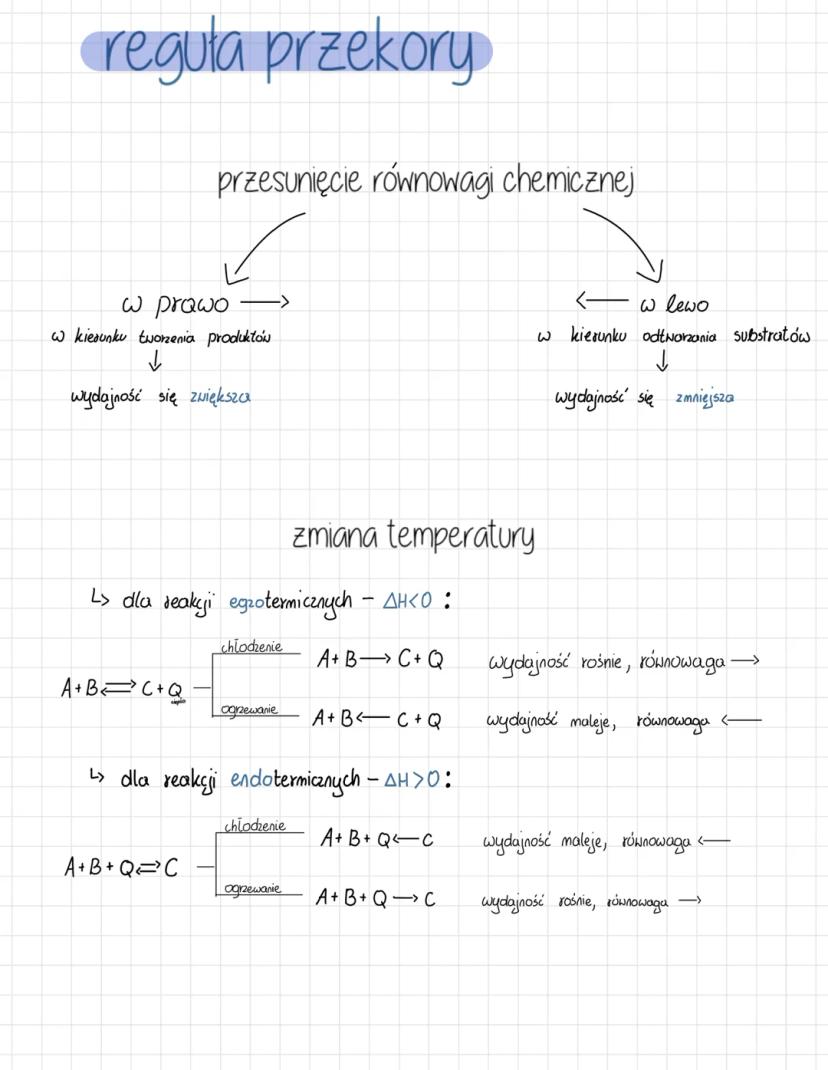
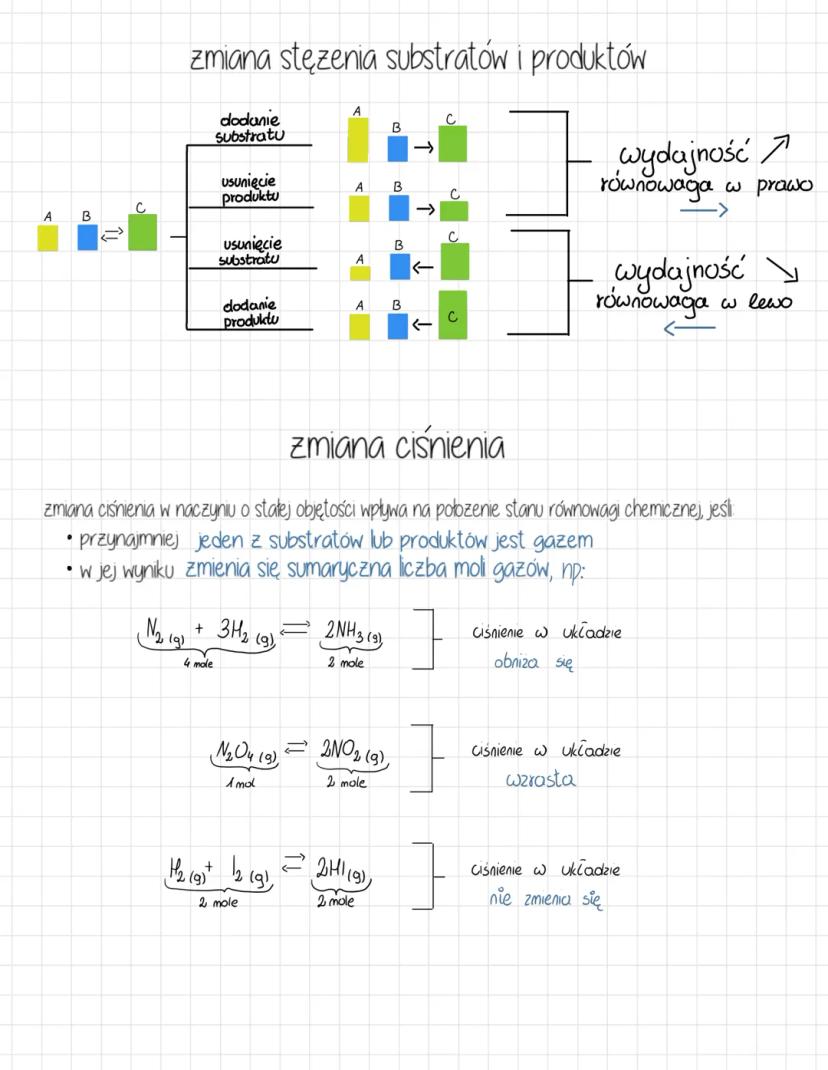
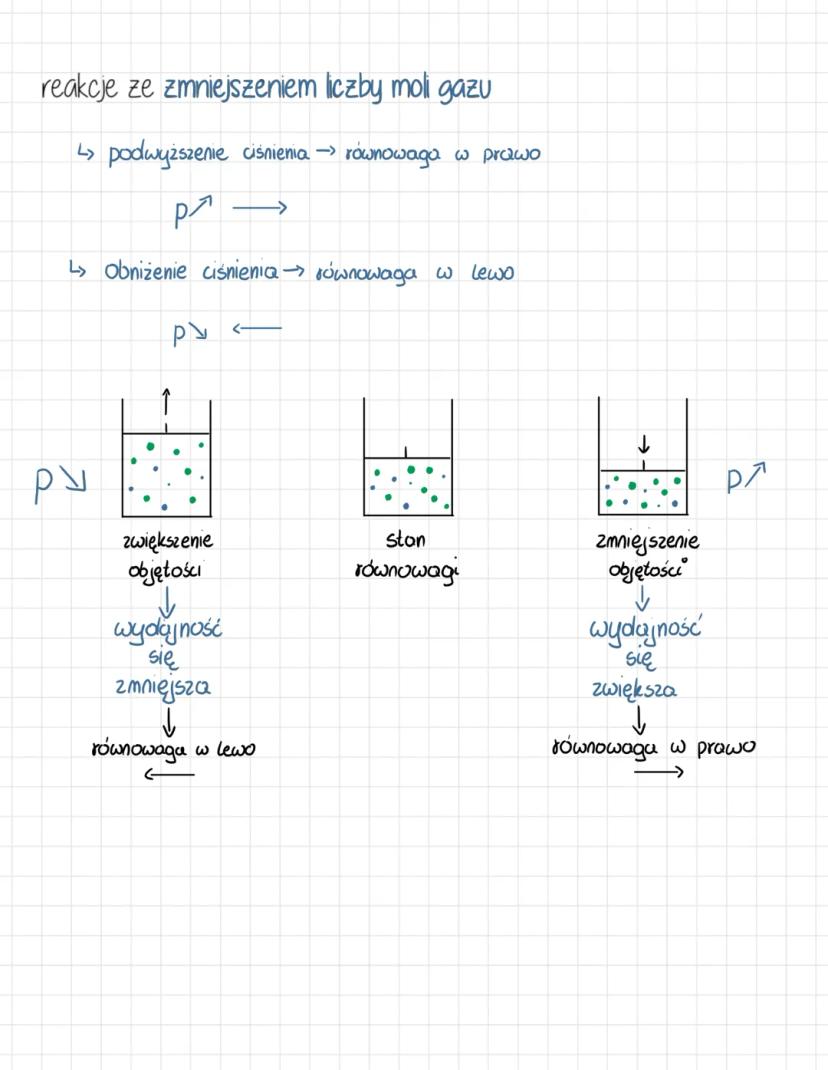
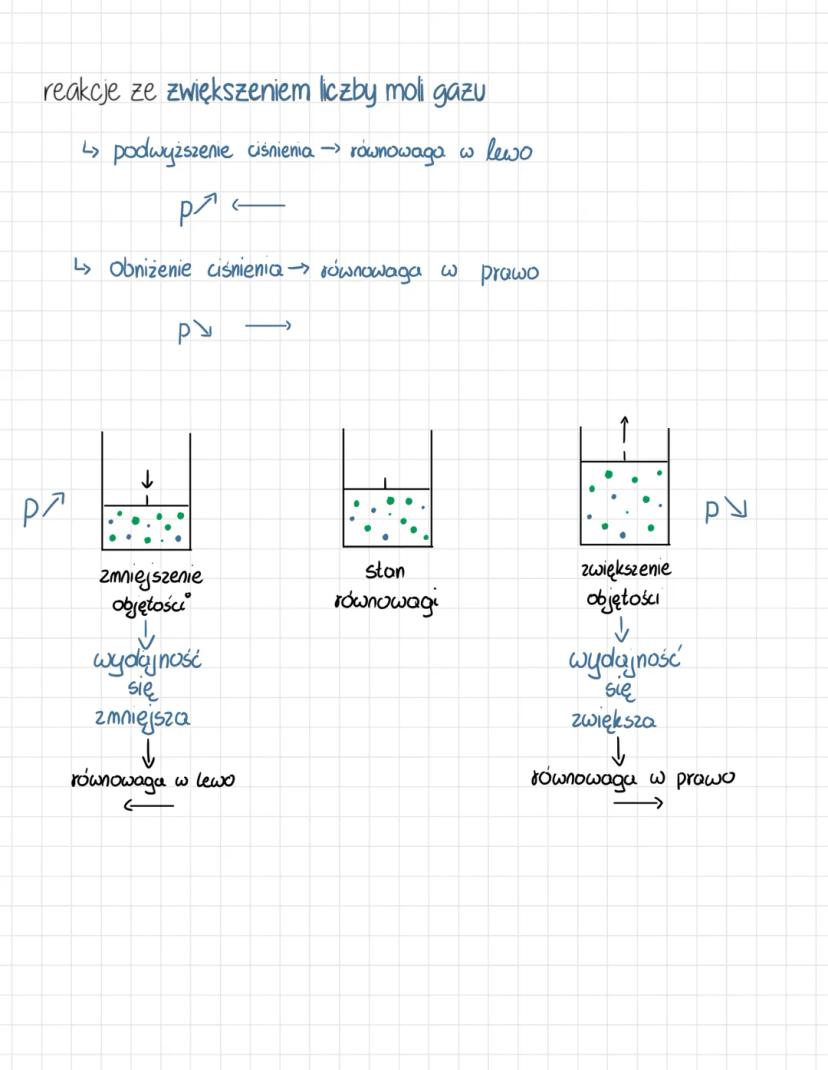
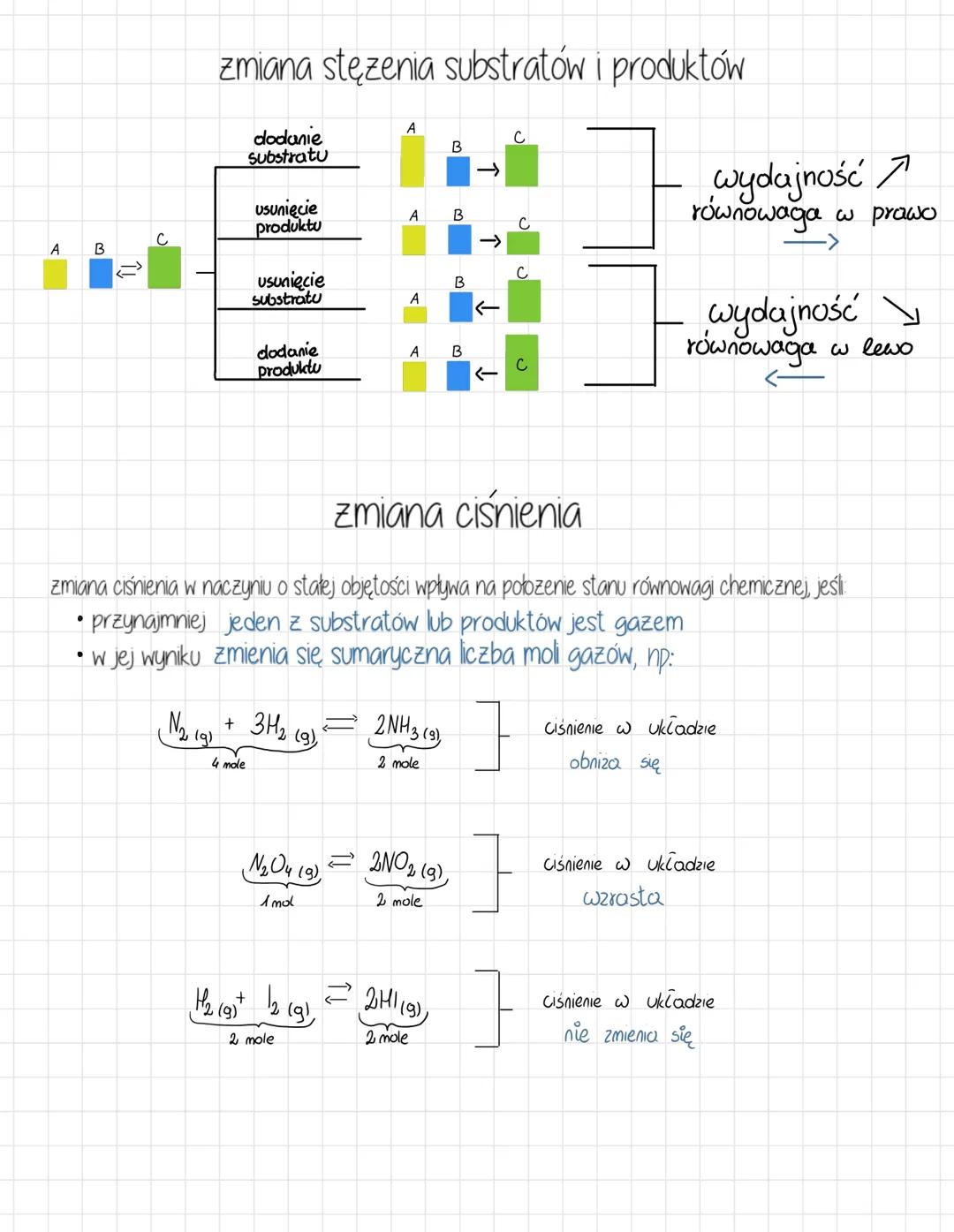
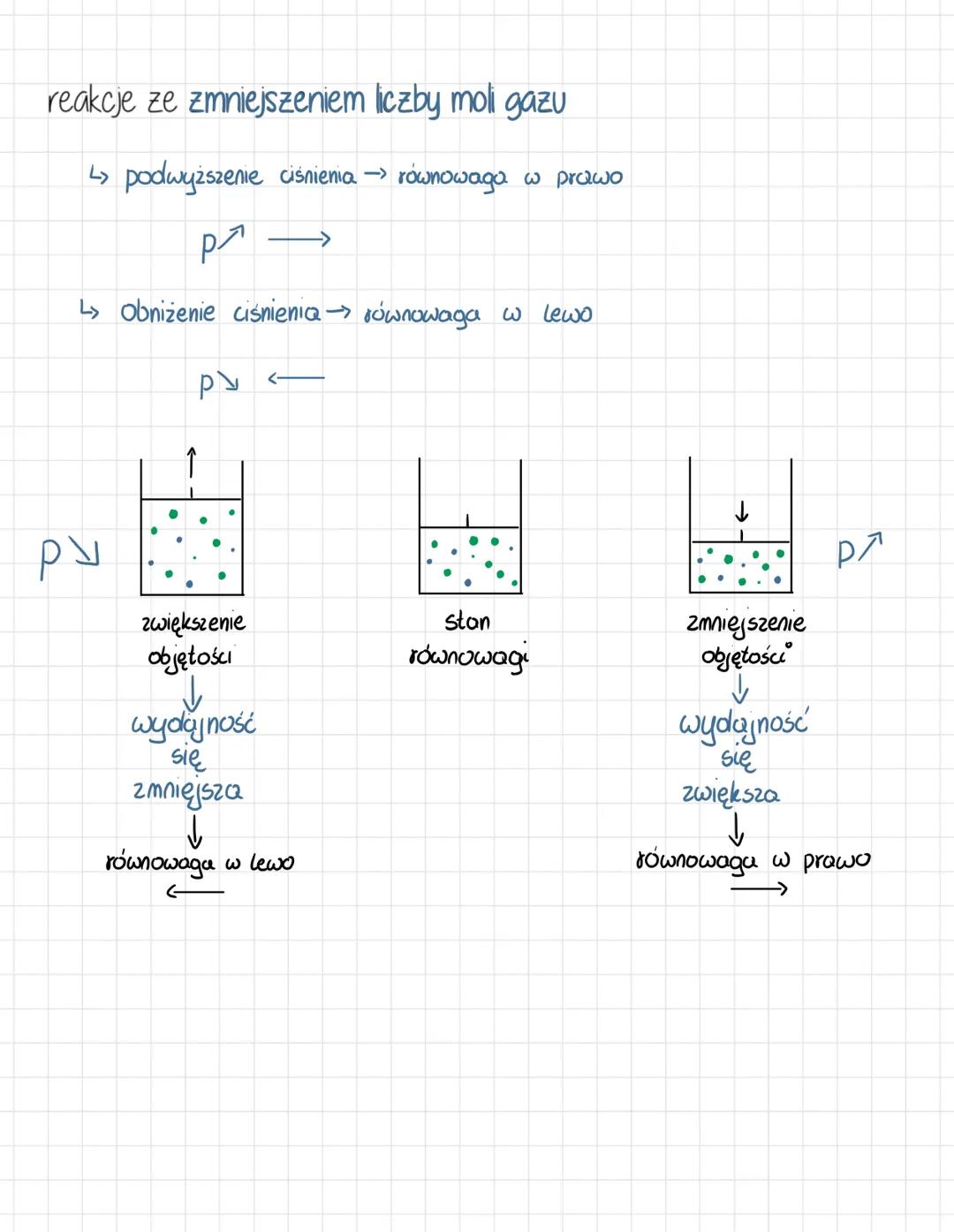
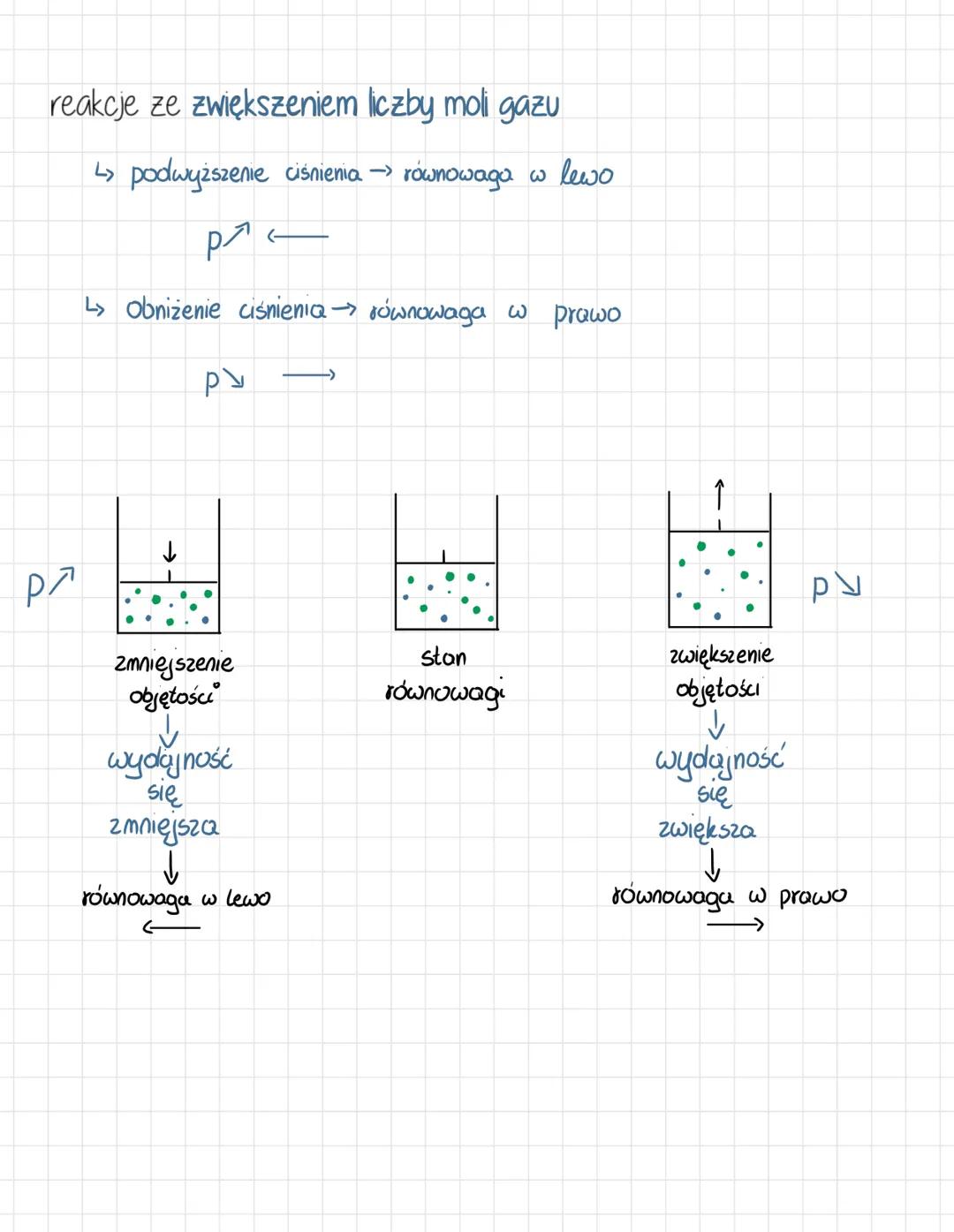
Reguła przekory i wpływ temperatury
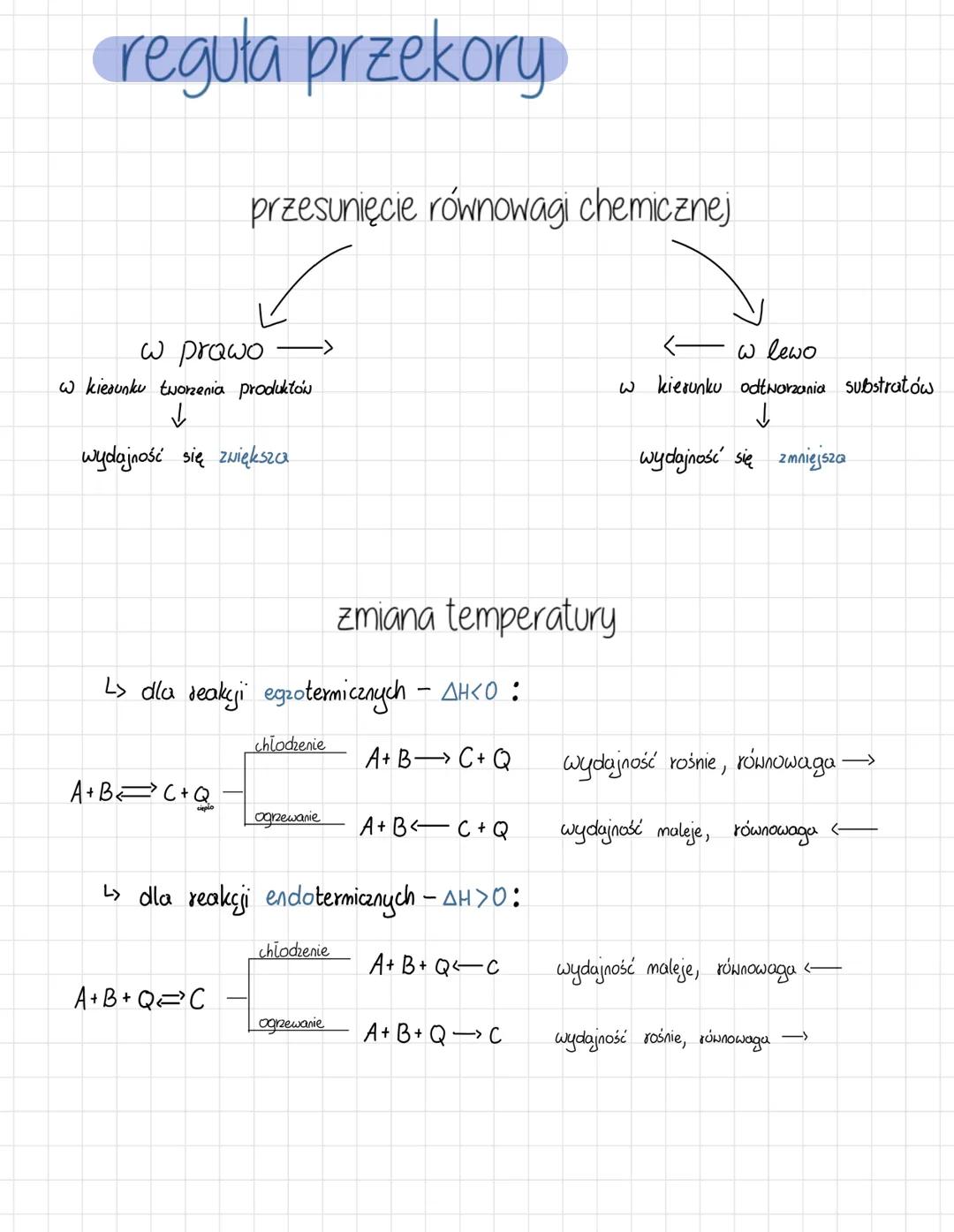
Kiedy równowaga chemiczna zostaje zaburzona, układ reaguje tak, aby przeciwdziałać tej zmianie. Przesunięcie równowagi w prawo (w kierunku tworzenia produktów) zwiększa wydajność reakcji, natomiast przesunięcie w lewo (w kierunku odtwarzania substratów) ją zmniejsza.
Dla reakcji egzotermicznych (ΔH<0), które wydzielają ciepło A+B→C+Q, chłodzenie przesuwa równowagę w prawo, zwiększając wydajność. Ogrzewanie działa przeciwnie - przesuwa równowagę w lewo, zmniejszając wydajność.
Z kolei dla reakcji endotermicznych (ΔH>0), które pochłaniają ciepło A+B+Q→C, efekt jest odwrotny. Chłodzenie zmniejsza wydajność, przesuwając równowagę w lewo, podczas gdy ogrzewanie zwiększa wydajność, przesuwając równowagę w prawo.
💡 Warto zapamiętać: Ciepło możesz traktować jak reagent! W reakcjach egzotermicznych ciepło jest produktem, a w endotermicznych - substratem. To pomaga przewidzieć kierunek przesunięcia równowagi.