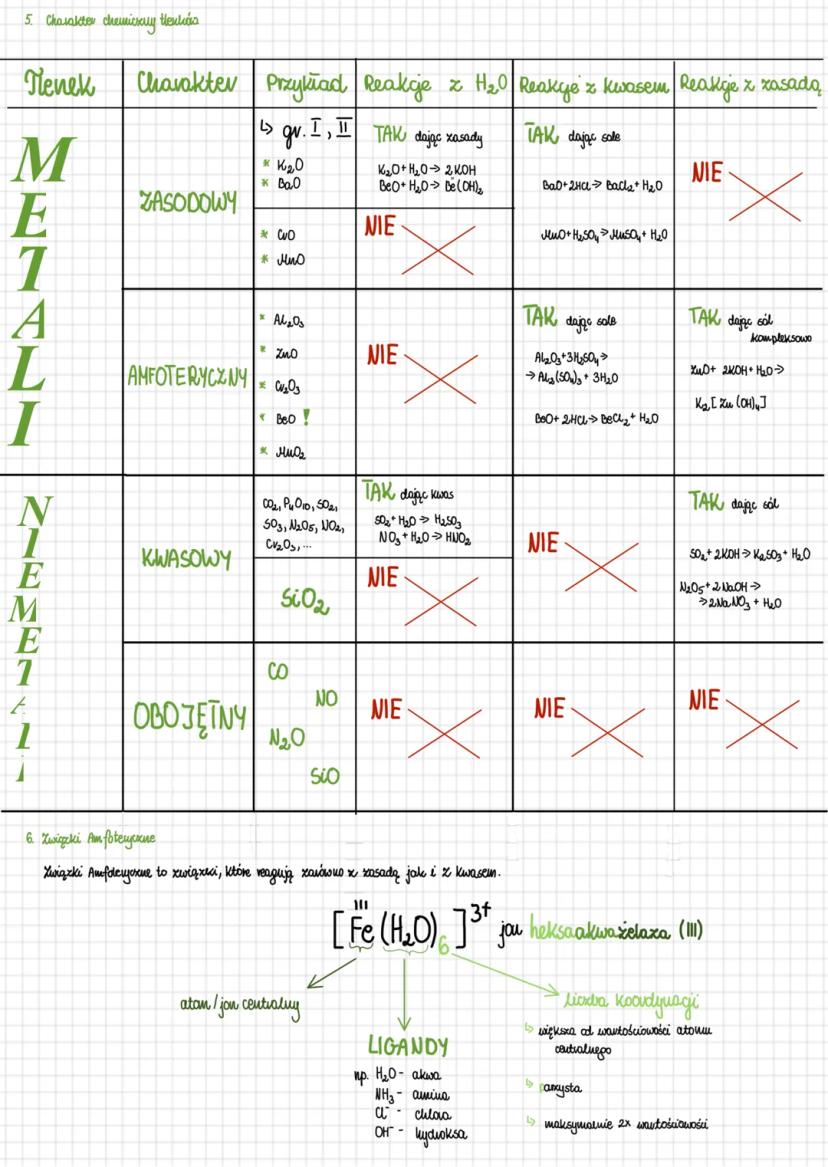
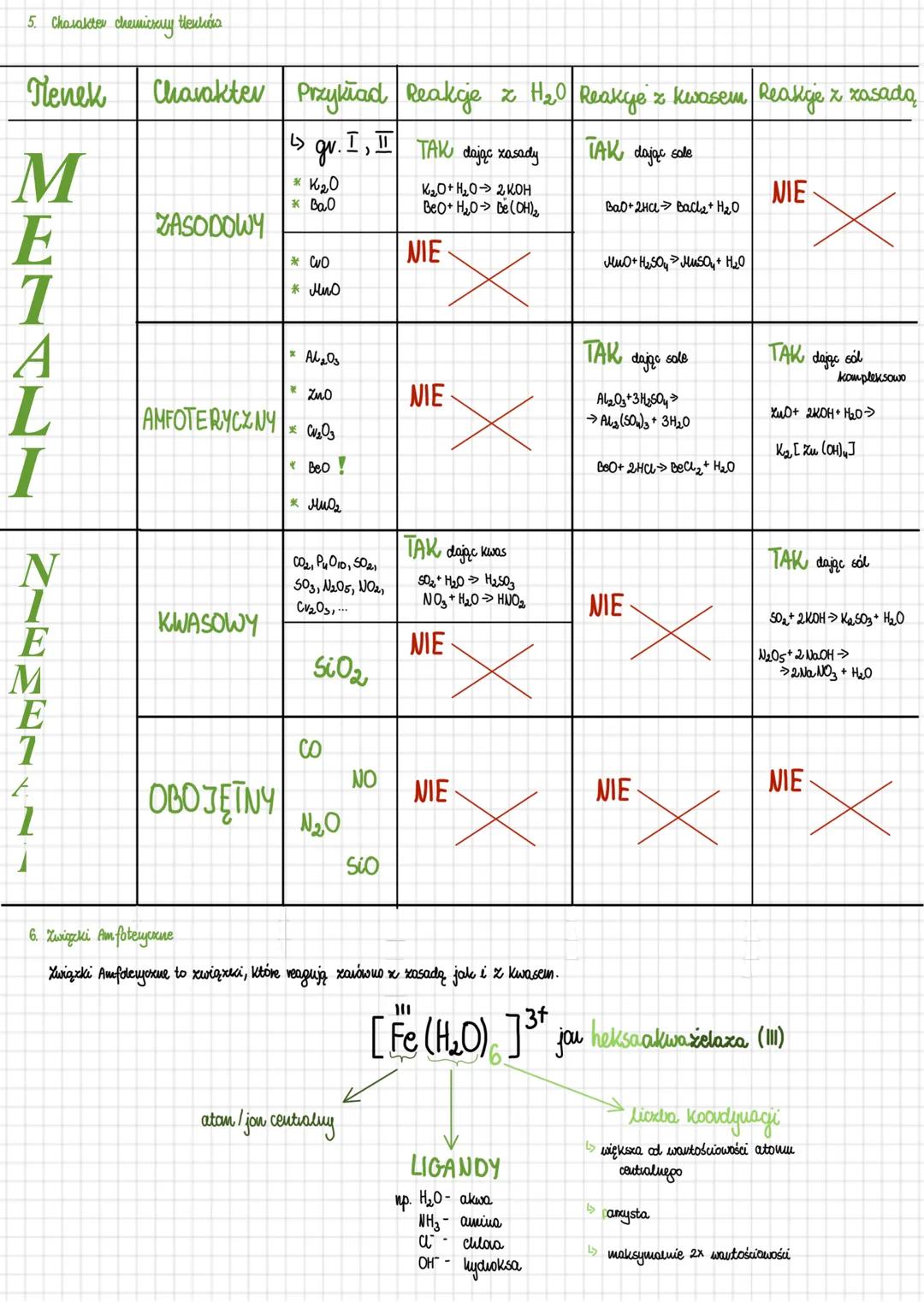
Charakter chemiczny tlenków
Tlenki możemy podzielić na kilka rodzajów w zależności od ich charakteru chemicznego. Tlenki zasadowe (np. K₂O, BaO) to głównie tlenki metali grup I i II. Reagują one z wodą, tworząc zasady K2O+H2O→2KOH oraz z kwasami, dając sole BaO+2HCl→BaCl2+H2O.
Tlenki amfoteryczne (np. Al₂O₃, ZnO, BeO) reagują zarówno z kwasami jak i z zasadami. Z kwasami tworzą sole Al2O3+3H2SO4→Al2(SO4)3+3H2O, a z zasadami tworzą sole kompleksowe ZnO+2KOH+H2O→K2[Zn(OH)4].
Tlenki kwasowe to głównie tlenki niemetali (CO₂, SO₂, N₂O₅). Z wodą tworzą kwasy SO2+H2O→H2SO3, a z zasadami tworzą sole SO2+2KOH→K2SO3+H2O. Natomiast tlenki obojętne (CO, NO, N₂O) nie reagują ani z kwasami, ani z zasadami.
🧪 Warto zapamiętać: Tlenki metali mają zwykle charakter zasadowy lub amfoteryczny, podczas gdy tlenki niemetali są kwasowe. To pomoże Ci przewidzieć zachowanie tlenków w różnych reakcjach!
Związki amfoteryczne to te, które reagują zarówno z kwasami jak i z zasadami. Przykładem może być jon [Fe(H₂O)₆]³⁺ (jon heksaakwa żelaza III), w którym atom centralny (Fe) otoczony jest ligandami (H₂O). Liczba koordynacji określa ilość ligandów i jest zazwyczaj większa od wartościowości atomu centralnego.