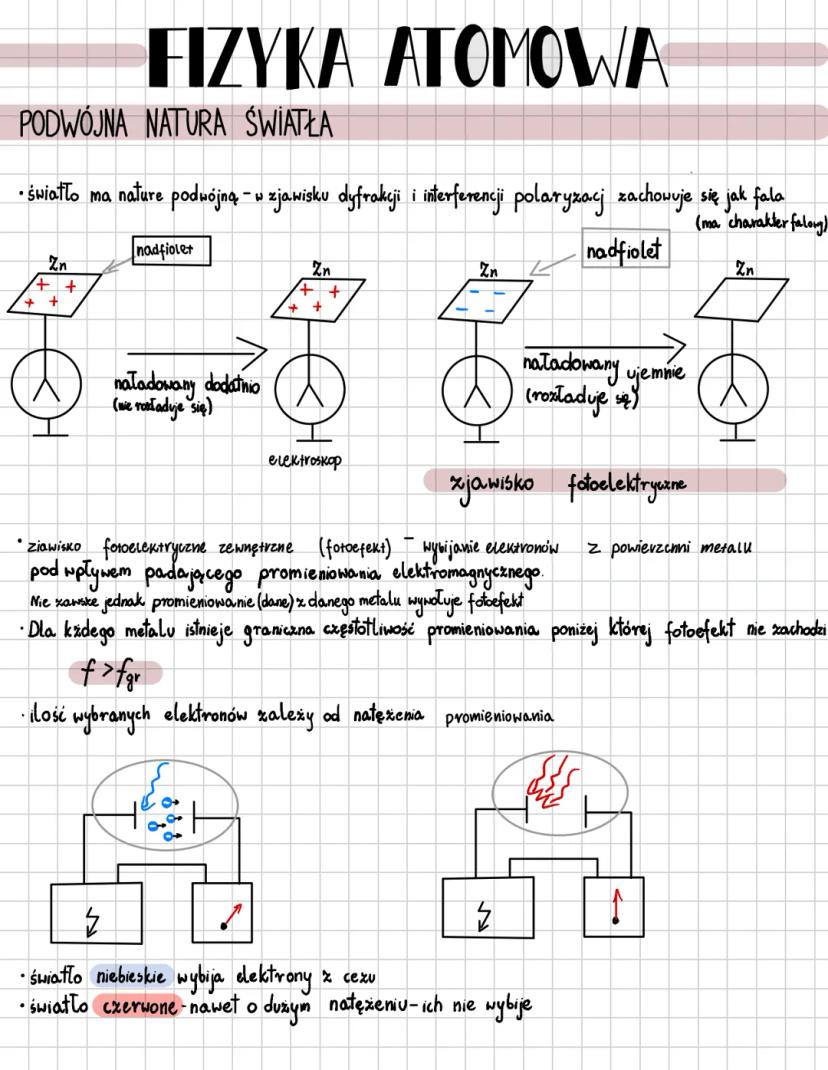
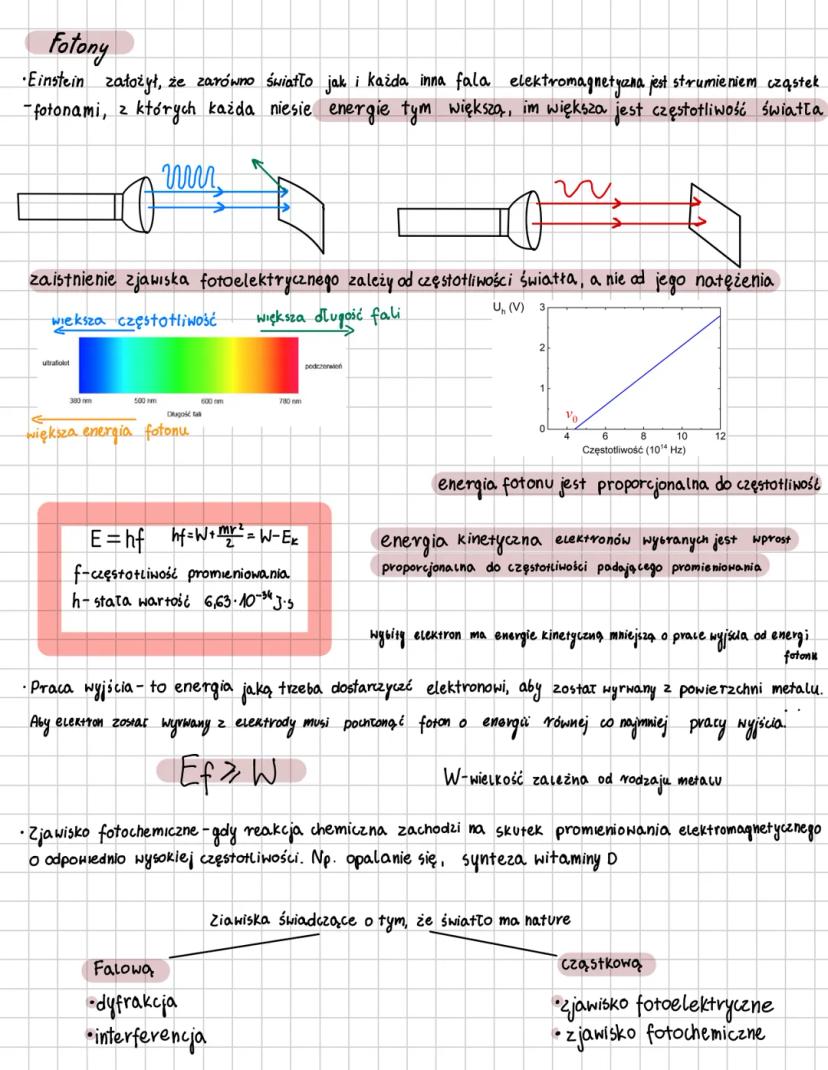
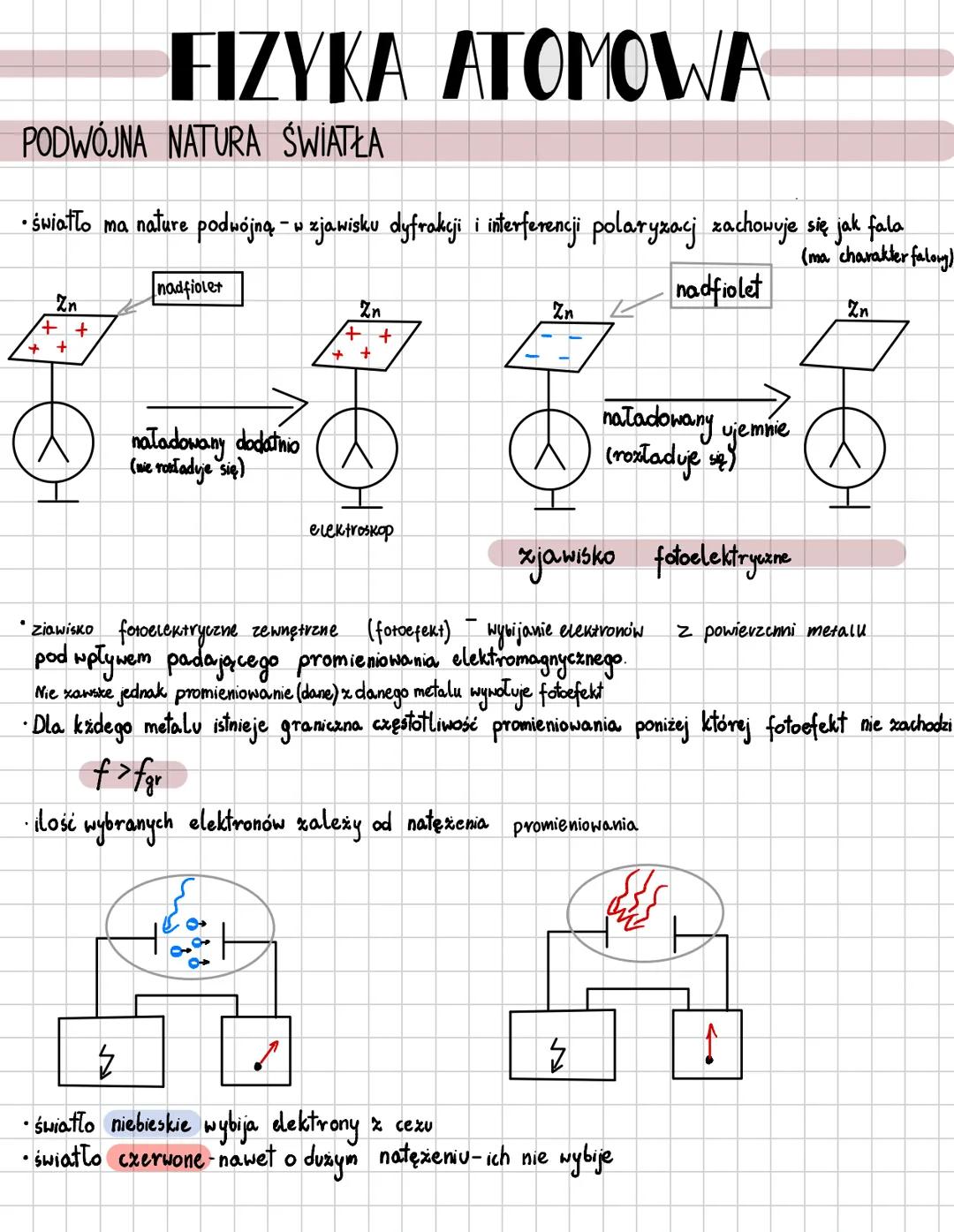
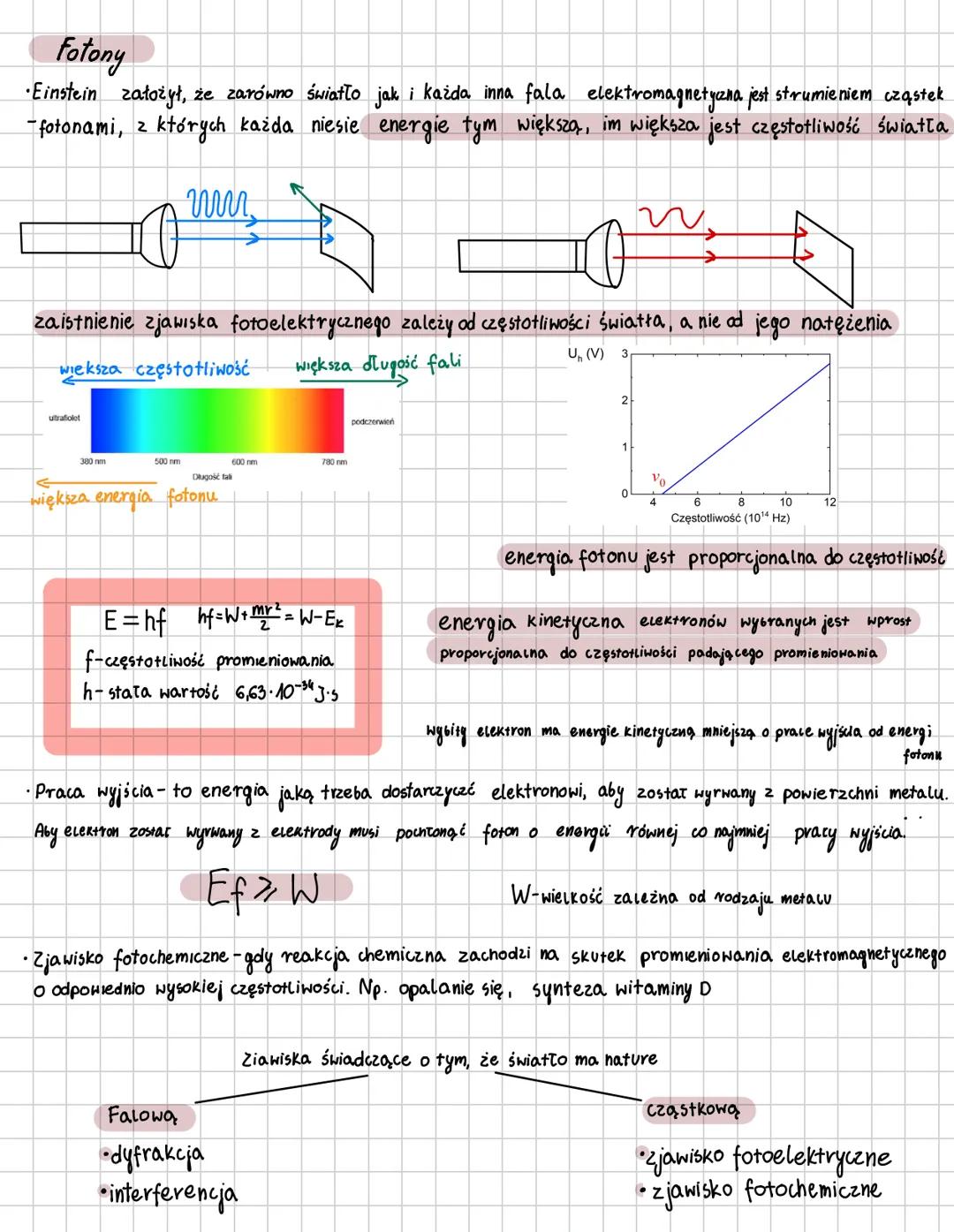
Model atomu Bohra
Niels Bohr zrewolucjonizował fizykę, tworząc kwantowy model atomu oparty na dwóch kluczowych postulatach. Pierwszy zakłada, że elektrony krążą tylko po ściśle określonych orbitach, których moment pędu jest całkowitą wielokrotnością stałej Plancka przez 2π: mvr = nh/2π.
Elektrony poruszają się po okręgu dzięki sile elektrycznej, która działa jak siła dośrodkowa. Każda orbita oznaczona jest liczbą kwantową n n=1,2,3..., a jej promień rośnie proporcjonalnie do n².
⚡ Wyobraź sobie, że elektron to muzyk, który może grać tylko określone nuty (orbity), a nie dowolne dźwięki. Przeskakując między orbitami, emituje lub pochłania ściśle określone porcje energii - fotony!
Drugi postulat Bohra mówi, że przejście elektronu na orbitę dalszą od jądra wymaga pochłonięcia kwantu energii, a powrót na orbitę bliższą wiąże się z emisją kwantu. Energia fotonu odpowiada różnicy energii między orbitami: hf = Eₙ - Eₘ. Im wyższa orbita, tym większa energia elektronu, więc aby przejść wyżej, elektron musi pochłonąć foton o energii równej dokładnie różnicy między poziomami.