Wiązania chemiczne - ciąg dalszy
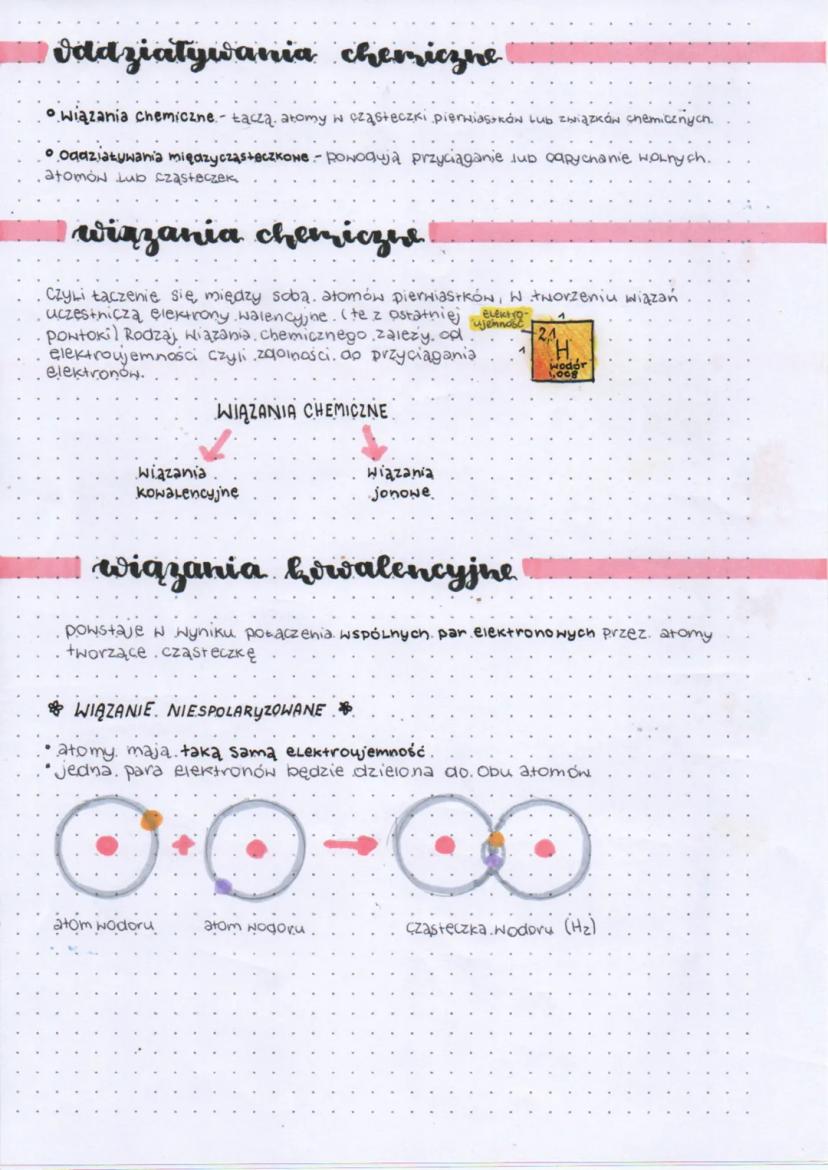
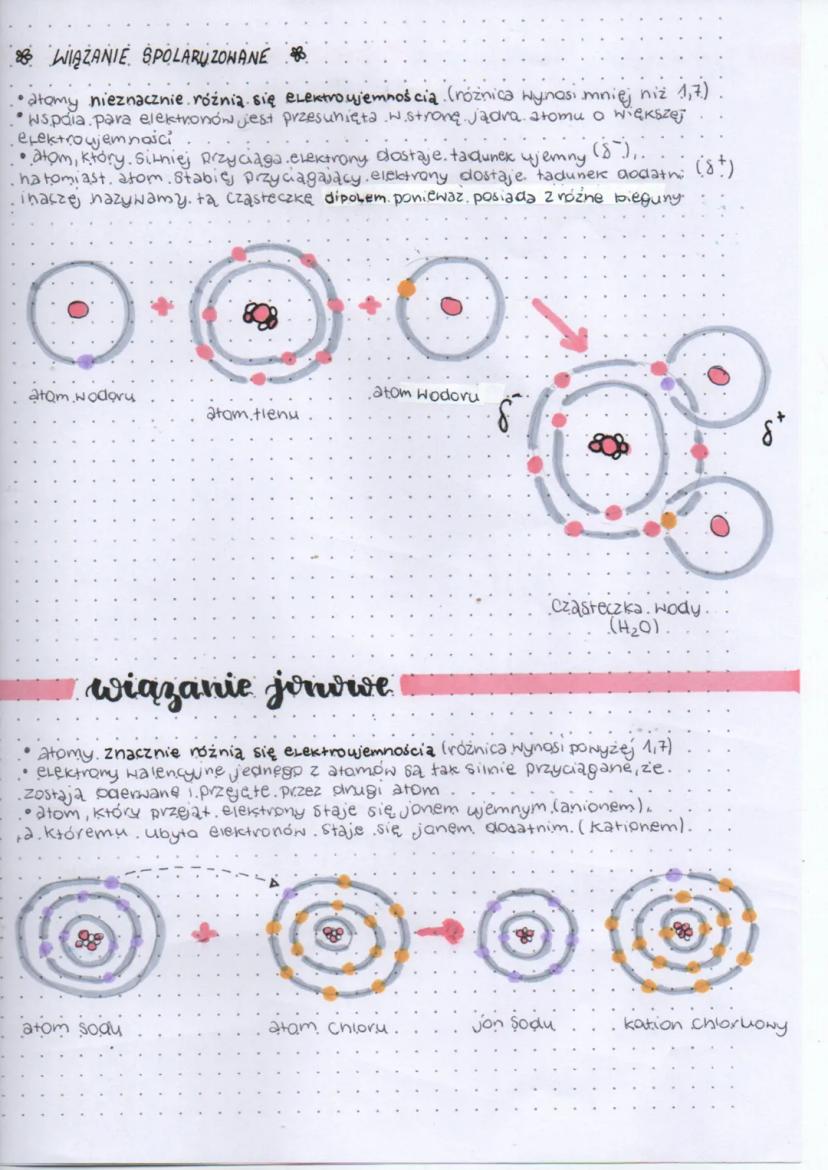
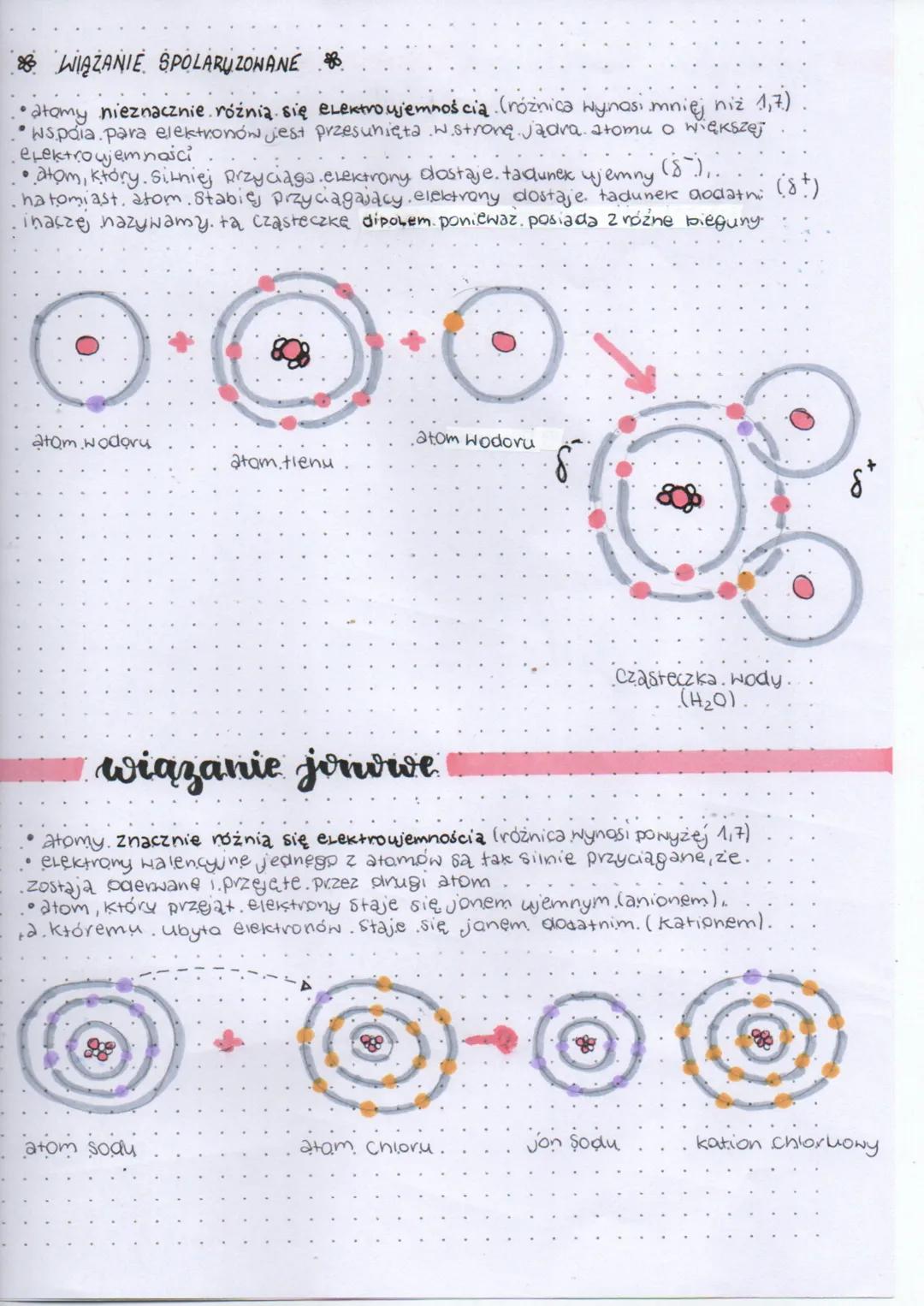
Wiązanie spolaryzowane powstaje, gdy atomy nieznacznie różnią się elektroujemnością (różnica mniejsza niż 1,7). W takim przypadku wspólna para elektronów jest przesunięta w stronę atomu o większej elektroujemności. Atom silniej przyciągający elektrony zyskuje częściowy ładunek ujemny (δ⁻), a atom słabiej przyciągający - częściowy ładunek dodatni (δ⁺).
Cząsteczka z takim wiązaniem staje się dipolem, ponieważ posiada dwa różne bieguny. Doskonałym przykładem jest cząsteczka wody (H₂O), w której tlen przyciąga elektrony silniej niż wodór, tworząc charakterystyczną strukturę z ładunkami cząstkowymi.
Wiązanie jonowe tworzy się, gdy różnica elektroujemności między atomami jest duża (powyżej 1,7). W takim przypadku elektrony walencyjne jednego atomu zostają całkowicie przejęte przez drugi atom. Atom, który przejął elektrony, staje się jonem ujemnym (anionem), a atom, który stracił elektrony - jonem dodatnim (kationem). Przykładem może być chlorek sodu (NaCl).
Pomoc: Aby łatwo zapamiętać różnicę między wiązaniami, pomyśl o nich jak o związkach międzyludzkich: kowalencyjne to dzielenie się (jak przyjaciele), a jonowe to całkowite oddanie (jak darowizna).