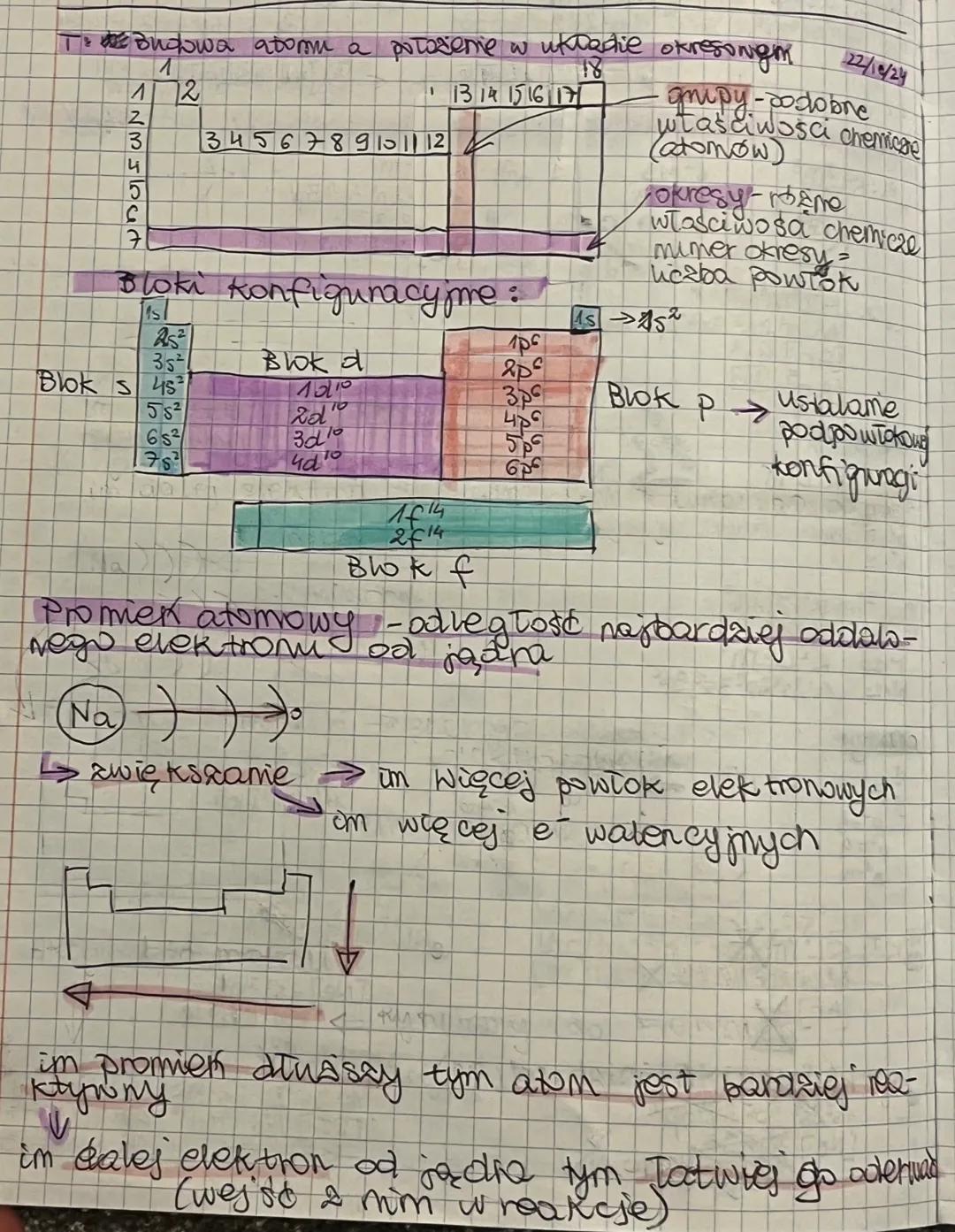
Budowa atomu a położenie w układzie okresowym
Układ okresowy jest zorganizowany w grupy (pionowe kolumny) i okresy (poziome rzędy). Pierwiastki w tej samej grupie mają podobne właściwości chemiczne, natomiast te w tym samym okresie mają różne właściwości, ale tę samą liczbę powłok elektronowych.
W układzie okresowym wyróżniamy cztery bloki konfiguracyjne: s, p, d i f. Każdy z nich oznacza różne zapełnianie podpowłok elektronowych. Blok s to 2 pierwiastki, blok p to 6 pierwiastków, blok d to 10 pierwiastków, a blok f to 14 pierwiastków w rzędzie.
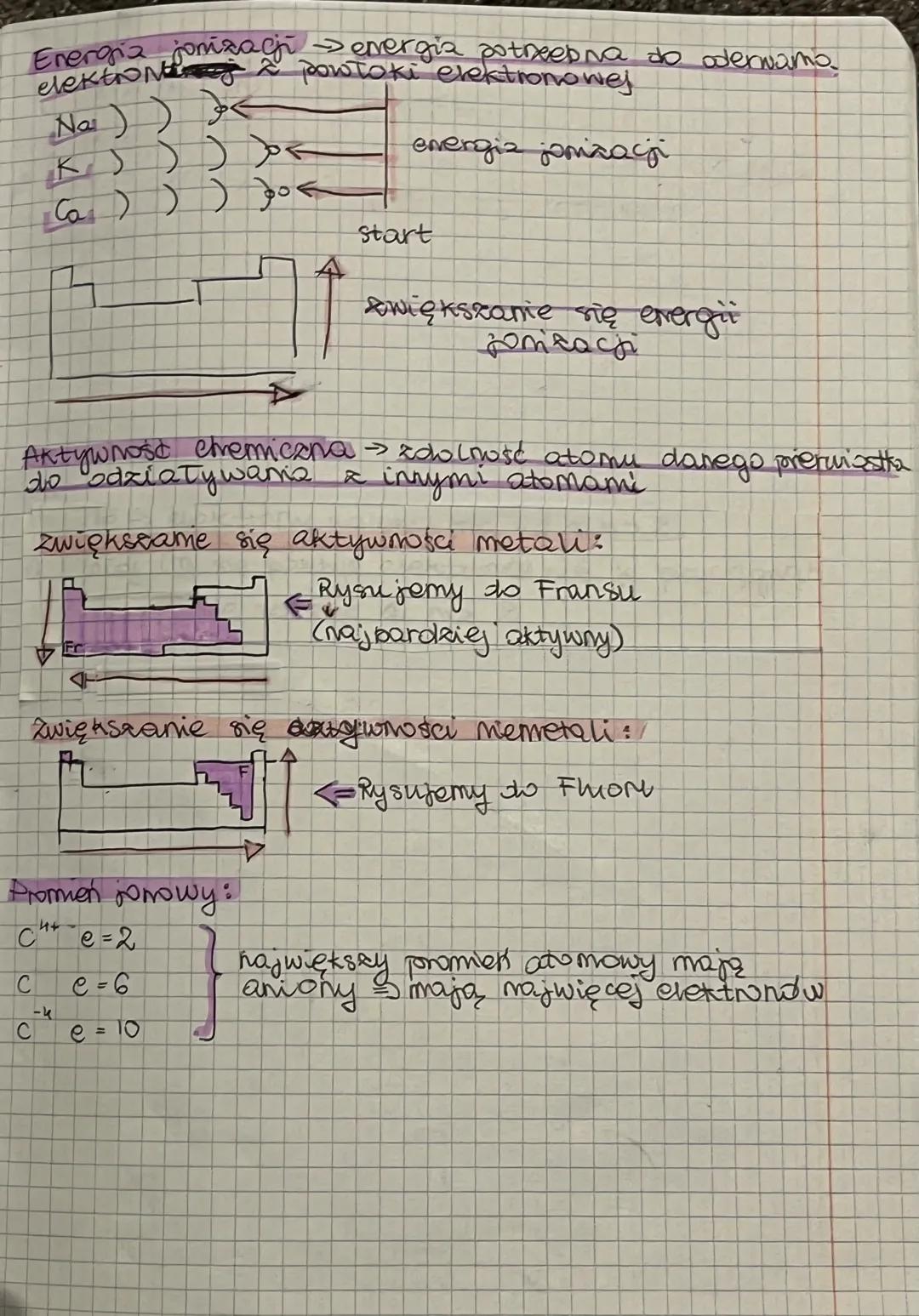
Promień atomowy to odległość najbardziej oddalonego elektronu od jądra. Im więcej powłok elektronowych ma atom, tym większy jest jego promień. Warto zapamiętać, że im większy promień atomowy, tym łatwiej jest oderwać elektron walencyjny, co czyni atom bardziej reaktywnym.
Wskazówka praktyczna: Zauważ, że promień atomowy zwiększa się w dół grupy i zmniejsza się w prawo wzdłuż okresu - to pomoże ci przewidywać reaktywność pierwiastków!