Kwasy beztlenowe
Kwasy beztlenowe powstają w reakcji wodoru z niemetalami. W przeciwieństwie do kwasów tlenowych, nie zawierają one atomów tlenu. Dwa najważniejsze przykłady to:
H₂ + Cl₂ → 2HCl (kwas chlorowodorowy)
H₂ + S → H₂S (kwas siarkowodorowy)
Warto pamiętać, że wodór i chlor występują w przyrodzie jako cząsteczki dwuatomowe. To oznacza, że reagują zawsze jako H₂ i Cl₂, nigdy jako pojedyncze atomy.
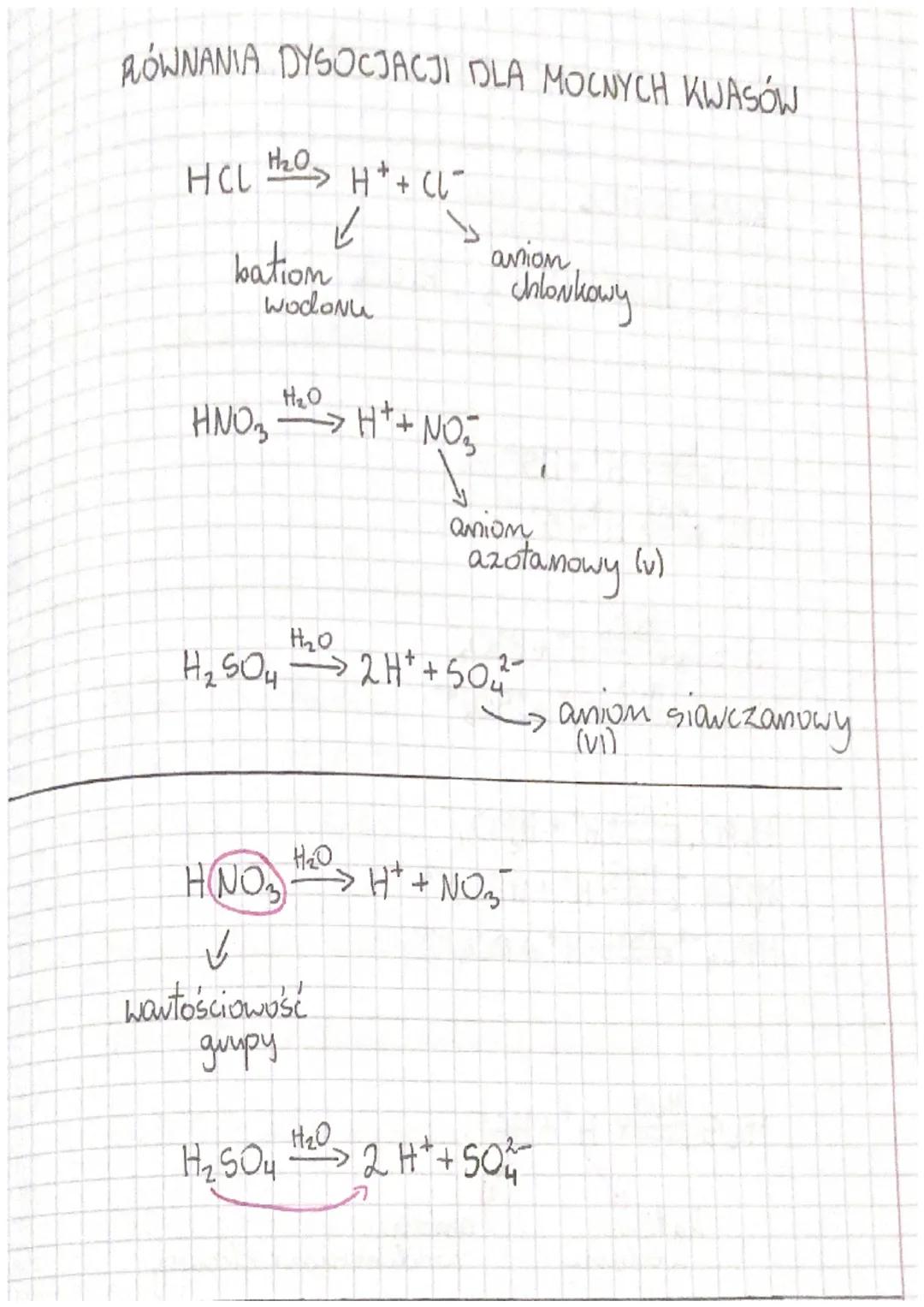
Kwasy mocne to takie, które całkowicie dysocjują w roztworze wodnym. Musisz zapamiętać trzy najważniejsze kwasy mocne: HCl, HNO₃, H₂SO₄. Te kwasy będą często pojawiać się w zadaniach z chemii.
Wskazówka: Zapamiętaj skrót HMS (jak okręt) - HCl, HNO₃, H₂SO₄ - to najważniejsze kwasy mocne!