Obliczenia na podstawie energii wiązań
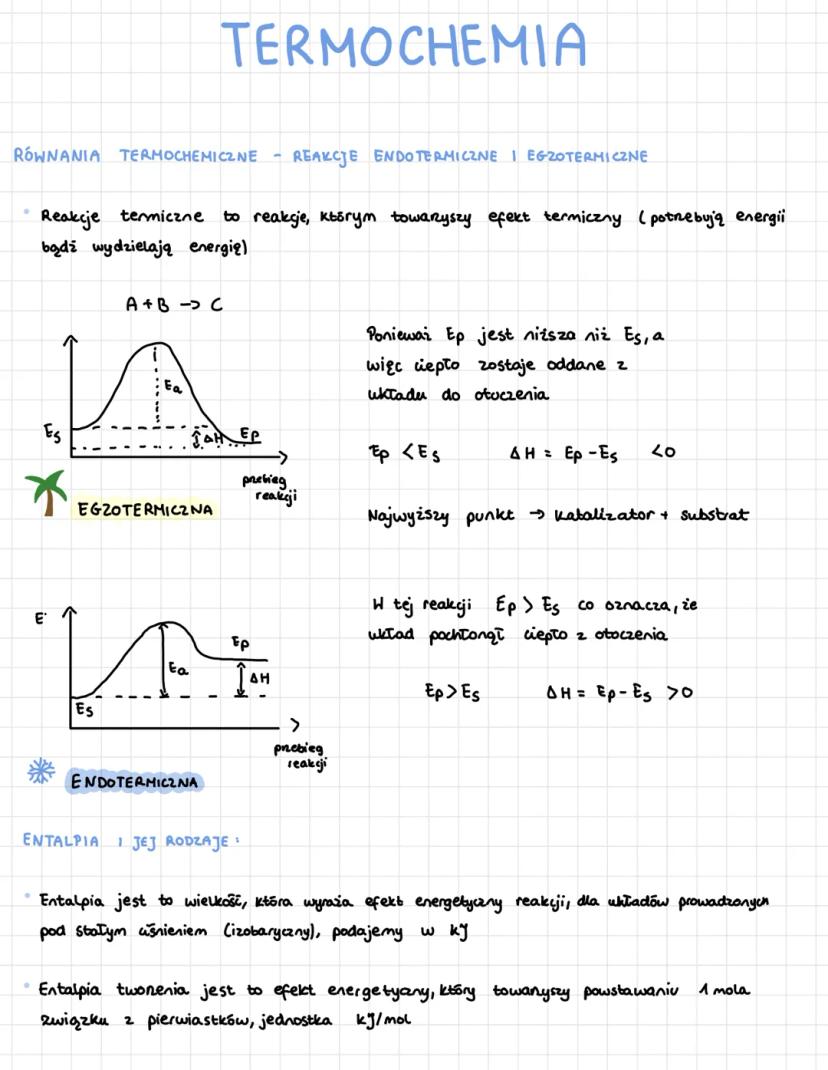
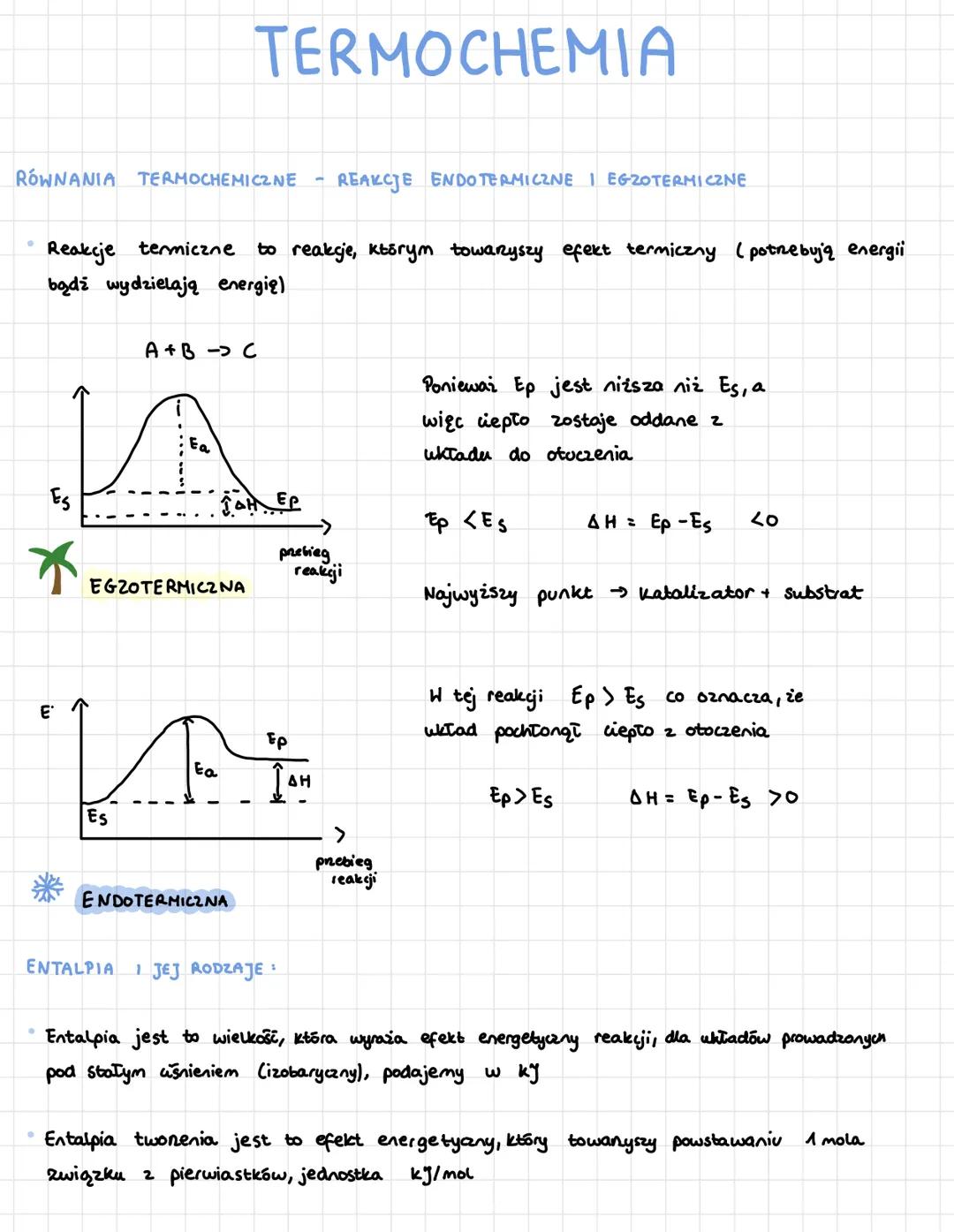
Energia wiązania to energia potrzebna do zerwania 1 mola wiązań w fazie gazowej. W reakcjach chemicznych niektóre wiązania się zrywają (Es), a inne powstają (Ep).
Wzór: ΔH = Es - Ep, gdzie Es to suma energii zrywanych wiązań, a Ep to suma energii tworzonych wiązań. Przykład dla spalania metanu: Es = 4×413 + 2×499 = 2650 kJ, Ep = 2×799 + 4×465 = 3458 kJ, więc ΔH = -808 kJ.
Ta metoda jest szczególnie przydatna dla reakcji w fazie gazowej, gdzie wszystkie cząsteczki są w postaci pojedynczych molekuł.
💡 Uwaga: Energia wiązania jest zawsze dodatnia (trzeba energii, żeby zerwać wiązanie), ale w obliczeniach odejmujemy ją, gdy wiązanie powstaje.