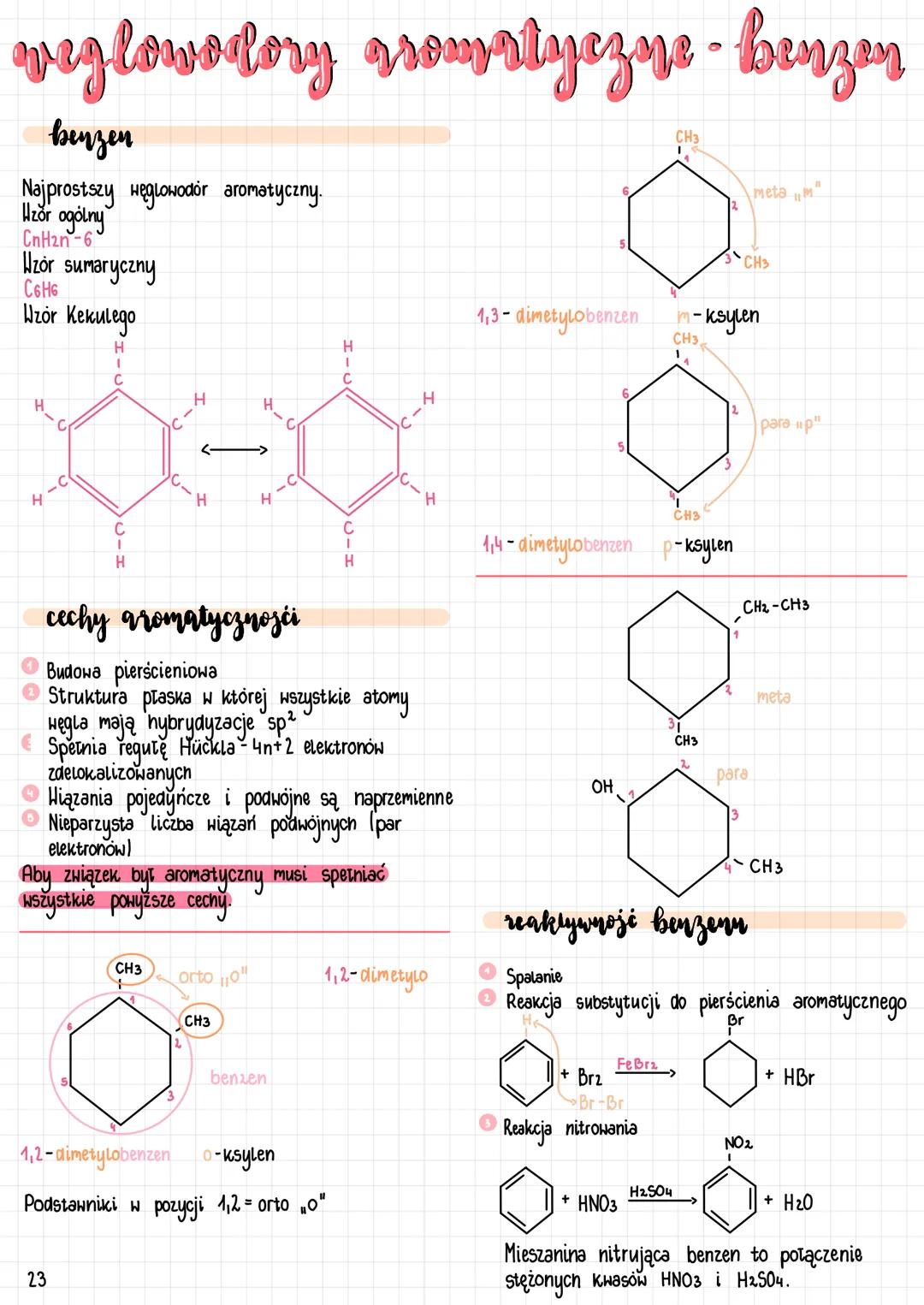
Benzen i węglowodory aromatyczne
Benzen to najprostszy węglowodór aromatyczny o wzorze sumarycznym C₆H₆ i wzorze ogólnym CₙH₂ₙ₋₆. Jego struktura, znana jako wzór Kekulégo, przedstawia płaski pierścień z naprzemiennymi wiązaniami pojedynczymi i podwójnymi.
Pochodne benzenu są nazywane według położenia podstawników. Wyróżniamy trzy możliwe pozycje: orto o− - gdy podstawniki znajdują się przy sąsiednich atomach węgla (pozycje 1,2), meta m− - gdy podstawniki są w pozycjach 1,3 oraz para p− - gdy podstawniki są w pozycjach 1,4. Przykładem są ksyleny (dimetylobenzeny) występujące jako o-ksylen, m-ksylen i p-ksylen.
Aby związek chemiczny można było uznać za aromatyczny, musi spełniać określone cechy aromatyczności: posiadać budowę pierścieniową, płaską strukturę z atomami węgla o hybrydyzacji sp², spełniać regułę Hückla 4n+2elektronoˊwzdelokalizowanych oraz mieć nieparzystą liczbę wiązań podwójnych.
💡 Warto zapamiętać! Benzen mimo obecności wiązań podwójnych nie ulega typowym reakcjom charakterystycznym dla alkenów (np. addycji). Zamiast tego preferuje reakcje substytucji, w których atom wodoru zostaje zastąpiony innym atomem lub grupą atomów.
Benzen ulega charakterystycznym reakcjom, takim jak bromowanie (z Br₂ w obecności FeBr₃, tworząc bromobenzen i HBr) oraz nitrowanie zmieszaninąnitrującąHNO3/H2SO4,dającnitrobenzeniwodę. Te reakcje to przykłady substytucji elektrofilowej aromatycznej - ważnego typu reakcji w chemii organicznej.